Реальную двухфазную систему, состоящую из фазы a и фазы b можно представить в виде, изображенном на рисунке.
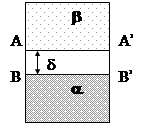 На данном рисунке d – есть толщина переходного слоя, внутри которого свойства вещества меняются от значения в фазе a до значения в фазе b. По разным физическим свойствам величина d может заметно различаться. При рассмотрении этого неоднородного межфазного слоя возникают серьезные трудности, как в теоретическом, так и экспериментальном отношении.
На данном рисунке d – есть толщина переходного слоя, внутри которого свойства вещества меняются от значения в фазе a до значения в фазе b. По разным физическим свойствам величина d может заметно различаться. При рассмотрении этого неоднородного межфазного слоя возникают серьезные трудности, как в теоретическом, так и экспериментальном отношении.
Гиббс разработал теоретически строгую термодинамическую теорию поверхностных явлений, исключающую из рассмотрения эту межфазную область.
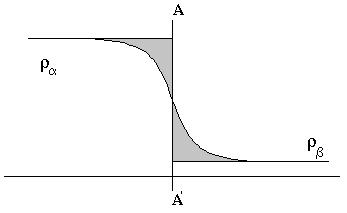
Рассмотрим равновесие фазы a (жидкий раствор) и фазы b (пар). Проследим изменение какого-либо локального свойства в переходной межфазной области. В качестве такого свойства на следующем рисунке показано изменение локальной плотности или локальной концентрации i компоненты ri , выраженную числом молекул в единице объема.

В переходной области значение ri должно меняться от ri(a) до ri(b) . В зависимости от природы системы профиль изменения ri может иметь разную форму. Профиль плотности 1 типа будет наблюдаться для поверхностно не активных компонент, 2 типа – для поверхностно-активных компонент. Поверхностно-активные компоненты сосредотачиваются преимущественно на границе раздела фаз, поэтому их концентрация в межфазной области выше, чем в фазе a и b. Поскольку локальная концентрация, как и другие локальные свойства ассимптотически приближаются к своим объемным значениям, точного значения толщины переходного слоя между двумя фазами не существует. Очевидно, можно говорить лишь об эффективной толщине переходного слоя между двумя фазами, которая отражает ширину зоны наиболее существенного изменения локальных свойств.
В методе Гиббса трудность нахождения границ переходной зоны обходится выбором некоторой гипотетической поверхности А-А, лежащей в переходной зоне и разделяющей объем всей системы V на две части Va и Vb. Рассмотрение реальной физической системы заменяется рассмотрением гипотетической (т.е. реально не существующей) системы, состоящей из двух фаз a и b, которые остаются строго однородными вплоть до определенной выше разделяющей поверхности и имеют следовательно, объемы Va и Vb. 
 |
 |
Пусть Ni(a) и Ni(b) -числа молекул i сорта в упомянутых гипотетических фазах a и b, а Ni - число молекул в реальной системе. В общем случае Ni ¹ Ni(a) + Ni(b) . Однако, можно записать Ni ¹ Ni(a) + Ni(b) + Ni(S), где Ni(S) - добавка, связанная с существованием в реальной системе межфазной области.
В случае однокомпонентной системы можно выбрать разделяющую поверхность так, чтобы эта добавка Nis была равна нулю. Эта особая разделяющая поверхность называется эквимолекулярной разделяющей поверхностью.
Аналогично числу молекул, любое экстенсивное термодинамическое свойство всей системы можно рассмотреть относительно произвольно выбранной разделяющей поверхности как сумму вклада фазы a, b и межфазной области.
Например, свободная энергия
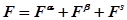 .
.
Если система находится в термодинамическом равновесии 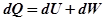 , где
, где 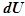
 – внутренняя энергия,
– внутренняя энергия, 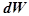 – элементарная работа, производимая системой.
– элементарная работа, производимая системой.
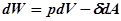
 , где
, где 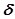 – удельная поверхностная энергия или поверхностное натяжение, А – площадь поверхности.
– удельная поверхностная энергия или поверхностное натяжение, А – площадь поверхности.
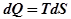 , где S – энтропия.
, где S – энтропия.
В результате 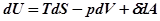
 , или используя выражение для свободной энергии Гельмгольца
, или используя выражение для свободной энергии Гельмгольца 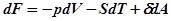
 .
.
В открытой системе, обменивающейся с окружающей средой, как веществом, так и энергией дифференциал свободной энергии должен иметь дополнительный член, связанный с этим изменением
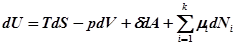
 .
.
Тогда выражение свободной энергии в реальной системе примет вид:
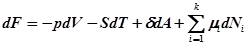 , где
, где 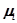
 – химический потенциал рассчитываемый на одну молекулу, k– число компонент, i – компонента.
– химический потенциал рассчитываемый на одну молекулу, k– число компонент, i – компонента.
В случае химического равновесия 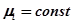 во всей системе.
во всей системе.
Для объемных фаз a и b гипотетической системы:
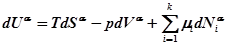

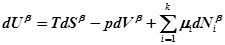
 .
.
Фундаментальное уравнение Гиббса для межфазного слоя:
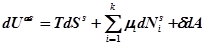
 (1)
(1)
так как данное уравнение являются однородными уравнениями первого порядка его можно привести к виду:
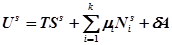 (2)
(2)
Дифференцируя данное уравнение получим:
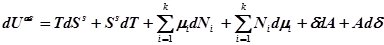
 (3)
(3)
Сравнивая уравнения (3) и (1), получим:
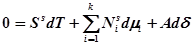 ,
,
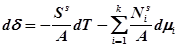 ,
,
где 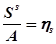 – удельная энтропия,
– удельная энтропия, 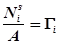 – поверхностная площадь молекулы.
– поверхностная площадь молекулы.
С учетом данных обозначений уравнение Гиббса для плоского межфазного слоя примет вид:
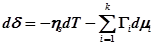 (4)
(4)
Из уравнения (2) получим:
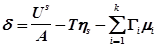
 , (5)
, (5)
так как 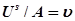
 , то уравнение (5) примет вид:
, то уравнение (5) примет вид:
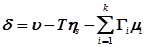 .
.
Если в качестве разделяющей поверхности выбрана эквимолекулярная поверхность, то из уравнения (4) следует: 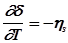 , а из уравнения (5) следует уравнение Гиббса-Гельмгольца для плоской границы:
, а из уравнения (5) следует уравнение Гиббса-Гельмгольца для плоской границы:
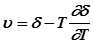 .
.
Необходимо подчеркнуть, что хотя Гi, 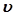 и s зависят от выбора разделяющей поверхности, общая форма полученных термодинамических уравнений оказывается инвариантной относительно сдвига разделяющей поверхности.
и s зависят от выбора разделяющей поверхности, общая форма полученных термодинамических уравнений оказывается инвариантной относительно сдвига разделяющей поверхности.
Адсорбция Гиббса при постоянной температуре:
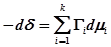 /
/
Для двухкомпонентной смеси:
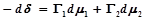
если Г1(1)=0, то 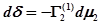
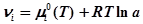 ,
, 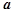 – активность компоненты
– активность компоненты
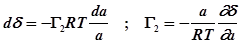 .
.
В случае идеального раствора 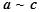 , тогда
, тогда 
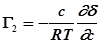 .
.
Отсюда следует, что направление процесса, концентрация вещества в поверхностном слое или переход его в объем, определяются знаком производной 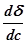 .
.
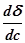 < 0 – величина адсорбции положительна,
< 0 – величина адсорбции положительна,
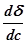 > 0 – величина адсорбции отрицательна.
> 0 – величина адсорбции отрицательна.
G=- 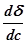 – поверхностная активность.
– поверхностная активность.
Эти два случая реализуются в зависимости от соотношения между силами взаимодействия молекул растворенного вещества и растворителя. Если молекулы растворенного вещества притягиваются молекулами растворителя слабее, чем молекулы самого растворителя между собой, то из поверхностного слоя раствора внутрь жидкости будут втягиваться преимущественно молекулами растворителя. В этом случае поверхностный слой оказывается обедненным молекулами растворителя и обогащенным молекулами растворенного вещества. Это явление называется положительной адсорбцией. При положительной адсорбции поверхностная энергия e, а следовательно и поверхностное натяжение раствора s понижается. Вещества, вызывающие понижение поверхностного натяжения раствора, называются поверхностно-активными веществами (сокращенно ПАВ). Ими являются различные спирты, мыла, жидкие кислоты. Противоположная зависимость G (C) наблюдается для поверхностно-неактивных веществ. Ими являются большинство неорганических солей, например, NaCl – поваренная соль. Молекулы солей, диссоциируя в воде на ионы, очень сильно взаимодействуют с полярными молекулами воды, гораздо сильнее, чем сами молекулы воды между собой. Поэтому ионы солей из поверхностного слоя будут втягиваться внутрь раствора, в результате поверхностный слой водных растворов солей может состоять только из молекул воды, т.е. концентрация солей в поверхностном слое оказывается ниже, чем в объеме. Данное явление называется отрицательной адсорбцией.
Как следует из рис. 1, начиная с некоторой концентрации растворенного поверхностно-активного вещества, поверхностное натяжение раствора перестает изменяться. При данной концентрации величина адсорбции растворенного вещества достигает максимального значения Гmax, соответствующая случаю, когда на поверхности образуется мономолекулярный слой из молекул растворенного вещества. Если Гmax выразить в молях на 1 см2 поверхности, то можно найти значение площади которую занимает одна молекула растворенного вещества в поверхностном слое:
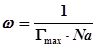 ,
,
где Na – число Авогадро.
Зная Гmax можно также рассчитать толщину поверхностной пленки l:
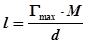 ,
,
где M – молекулярный вес растворенного вещества, d – его плотность. Здесь Гmax·M – масса 1 см2 пленки, а при делении на плотность получаем объем пленки с площадью 1 см2, численно равной ее толщине. Количественное соотношение между величиной адсорбции Г, т.е. избытком растворенного вещества в моль на 1 см2 и изменением поверхностного натяжения с концентрацией раствора dG/dC, определяется уравнением Гиббса:
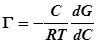 .
.
Из уравнения Гиббса видно, что если растворенное вещество понижает поверхностное натяжение, то dG/dC < 0 и Г < 0, т.е. адсорбция является положительной (концентрация в поверхностном слое больше, чем в растворе). Напротив, если растворенное вещество повышает поверхностное натяжение раствора, то dG/dC > 0 и Г > 0, т.е. адсорбция является отрицательной (концентрация в поверхностном слое меньше, чем в растворе). Приведем несложный расчет, показывающий как по уравнению Гиббса и экспериментальной кривой G (C) найти Г (С) и Гmax.
Прежде всего экспериментальную кривую разбиваем на ряд участков, на которые она может быть экстраполирована отрезком прямой. На каждом из этих участков 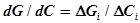 , а величина адсорбции
, а величина адсорбции
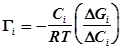 ,
,
где Сi – концентрация, соответствующая середине этого линейного участка.
Предельная величина адсорбции равна сумме Гi по всем линейным участкам, на которые разбили экспериментальную кривую, начиная от С = 0. Как следует из уравнения Гиббса, размерность Г не зависит от размерности в которых выражается С и определяется размерностью R. Наиболее часто С выражают в молях растворенного вещества на один литр раствора (моль/л), но можно пользоваться и объемными или весовыми процентами.
 2015-03-07
2015-03-07 684
684






