| Окисленная форма | Восстановленная форма | Уравнение реакции | Е0, эВ |
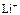
| 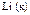
| 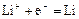
| -3,04 |
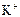
| 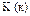
| 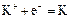
| -2,92 |
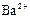
| 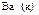
| 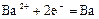
| -2,90 |
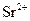
| 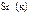
| 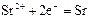
| -2,89 |
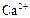
| 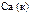
| 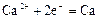
| -2,87 |
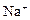
| 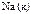
| 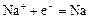
| -2,71 |
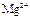
| 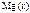
| 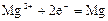
| -2,36 |
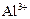
| 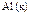
| 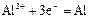
| -1,66 |
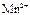
| 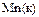
| 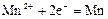
| -1,18 |
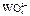
| 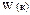
| 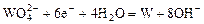
| -1,10 |
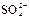
| 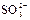
| 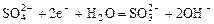
| -0,93 |
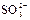
| 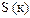
| 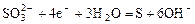
| -0,90 |
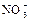
| 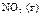
| 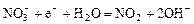
| -0,85 |
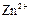
| 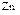
| 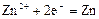
| -0,76 |
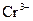
| 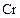
| 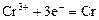
| -0,74 |
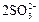
| 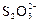
| 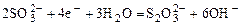
| -0,58 |
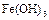
| 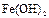
| 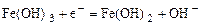
| -0,56 |
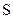
| 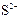
| 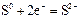
| -0,51 |
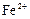
| 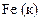
| 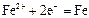
| -0,44 |
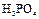
| 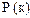
| 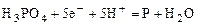
| -0,41 |
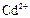
| 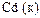
| 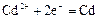
| -0,40 |
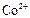
| 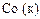
| 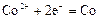
| -0,28 |
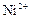
| 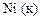
| 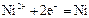
| -0,25 |
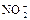
| 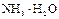
| 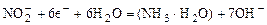
| -0,15 |
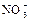
| 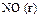
| 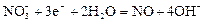
| -0,14 |
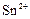
| 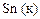
| 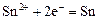
| -0,14 |
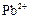
| 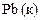
| 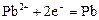
| -0,13 |
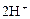
| 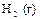
| 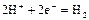
| -0,00 |
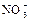
| 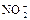
| 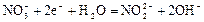
| +0,01 |
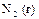
| 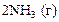
| 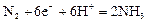
| +0,06 |
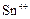
| 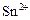
| 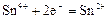
| +0,15 |
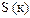
| 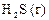
| 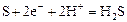
| +0,17 |
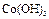
| 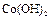
| 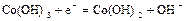
| +0,17 |
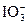
| 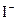
| 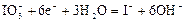
| +0,25 |
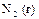
| 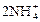
| 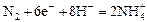
| +0,27 |
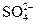
| 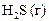
| 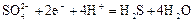
| +0,31 |
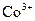
| 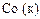
| 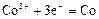
| +0,33 |
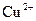
| 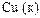
| 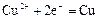
| +0,34 |
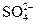
| 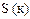
| 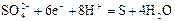
| +0,36 |
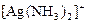
| 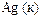
| 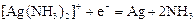
| +0,37 |
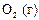
| 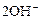
| 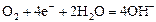
| +0,40 |
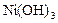
| 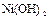
| 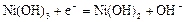
| +0,49 |
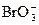
| 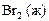
| 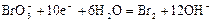
| +0,50 |
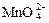
| 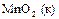
| 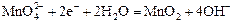
| +0,51 |
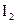
| 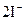
| 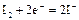
| +0,54 |
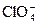
| 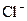
| 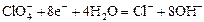
| +0,5 6 |
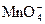
| 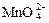
| 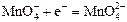
| +0,56 |
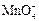
| 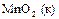
| 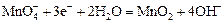
| +0,60 |
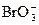
| 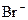
| 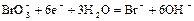
| +0,61 |
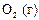
| 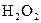
| 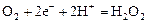
| +0,68 |
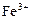
| 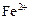
| 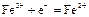
| +0,77 |
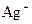
| 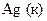
| 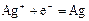
| +0,80 |
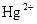
| 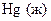
| 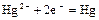
| +0,85 |
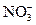
| 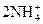
| 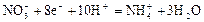
| +0,87 |
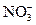
| 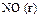
| 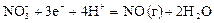
| +0,96 |
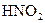
| 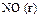
| 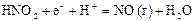
| +1,00 |
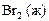
| 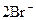
| 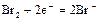
| +1,07 |
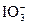
| 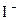
| 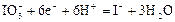
| +1,09 |
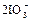
| 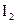
| 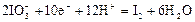
| +1,19 |
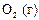
| 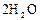
| 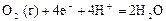
| +1,23 |
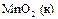
| 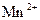
| 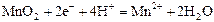
| +1,23 |
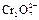
| 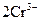
| 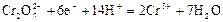
| +1,33 |
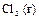
| 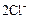
| 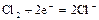
| +1,36 |
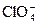
| 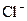
| 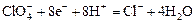
| +1,38 |
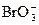
| 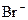
| 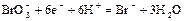
| +1,4 4 |
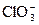
| 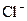
| 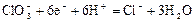
| +1,45 |
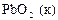
| 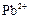
| 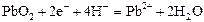
| +1,45 |
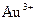
| 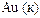
| 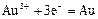
| +1,50 |
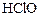
| 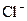
| 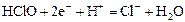
| +1,50 |
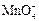
| 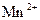
| 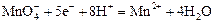
| +1,52 |
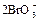
| 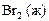
| 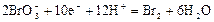
| +1,52 |
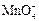
| 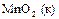
| 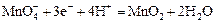
| +1,69 |
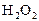
| 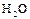
| 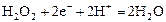
| +1,78 |
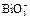
| 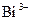
| 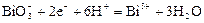
| +1,80 |
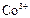
| 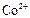
| 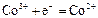
| +1,81 |
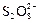
| 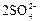
| 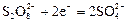
| +2,01 |
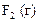
| 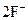
| 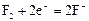
| +2,87 |
Ряд напряжений металлов
Li Rb K Cs Ca Na Mg Al Ti Mn Cr Zn Fe Cd Co Ni Sn Pb H Bi Cu Hg Ag Pt Au
Таблица 3.8
Константы нестойкости некоторых комплексных ионов
| Комплексный ион | Kн | Комплексный ион | Kн | Комплексный ион | Kн |
| [AgCl2]‑ | 2,3×10‑6 | [Ag(NН3)2]+ | 9×10‑8 | [Ag(S2O3)2]3‑ | 2,5×10‑14 |
| [Ag(CN)2]‑ | 1×10‑21 | [Ag(NO2)2]‑ | 1,3×10‑3 | [Au(CN)2]‑ | 5,01×10‑39 |
| [AlF6]3‑ | 1,4×10‑20 | [Cd(NH3)6]2+ | 7,3×10‑7 | [Cd(CN)4]2‑ | 1,4×10‑19 |
| [CdCl4]2‑ | 9×10‑3 | [CdI4]2‑ | 8×10‑7 | [Co(NН3)6]2+ | 7,7×10‑6 |
| [Co(NH3)6]3+ | 2,1×10‑13 | [Cu(CN)4]2‑ | 8×10‑20 | [Co(CNS)4]2‑ | 1,0×10‑3 |
| [Cu(CN)4]3‑ | 5×10‑28 | [Cu(NH3)4]2+ | 5×10‑14 | [CuCl4]2‑ | 2,4×10‑6 |
| [Cu(OH)4]2‑ | 6×10‑7 | [Fe(CN)6]4‑ | 1×10‑27 | [Fe(CN)6]3‑ | 1×10‑33 |
| [HgS2]2‑ | 1×10‑53 | [HgCl4]2‑ | 6×10‑17 | [HgBr4]2‑ | 2×10‑22 |
| [HgI4]2‑ | 5×10‑31 | [Hg(CN)4]2- | 4×10‑41 | [Hg(CNS)4]2‑ | 1×10‑22 |
| [Hg(NH3)4]2+ | 5,2×10‑20 | [Ni(NH3)6]2+ | 1,8×10‑9 | [Ni(CN)4]2‑ | 3,0×10‑16 |
| [PtCl4]2‑ | 1,0×10‑10 | [SiF6]2‑ | 6,3×10‑8 | [Zn(NH3)4]2+ | 3,5×10‑10 |
| [Zn(CN)4]2‑ | 1,0×10‑15 | [Zn(OH)4]2‑ | 3,6×10‑16 | [Zn(CNS)4]2‑ | 5×10‑2 |
Таблица 3.9
 2015-04-01
2015-04-01 596
596








