Вопрос 1а. Можно отметить несколько основных факторов, которые реализуются при связывании субстрата ферментом и образования так называемого фермент-субстратного комплекса: это факторы сближения реакционных групп, их фиксации и ориентации. Эти факторы в конечном итоге изменяют путь реакции, так как реакция идет через другие переходные состояния, и понижают энергию активации.
Вопрос 1б. Уравнение протекающей реакции: H2O2 ® H2O + 1/2O2,
отношение скоростей можно рассчитать из отношения констант скоростей:
k (с платиной) / k (без катализатора) =
exp(–12·4,184·103/ RT) / exp(–18·4,184·103/ RT) = 2,36·104.
Поскольку энергия активации находится в показателе степени, следовательно, изменение энергии активации всего на 6 ккал/моль приводит к изменению скорости реакции разложения перекиси более чем на 4 порядка при катализе мелкодисперсной платиной, и еще на
k (с ферментом) / k (с платиной) =
exp(–5,6·4,184·103/ RT) / exp(–12·4,184·103/ RT) = 4,62·104,
т. е. более чем на 4 порядка при действии фермента.
Вопрос 2
Частичный гидролиз будет приводить к разрыву какой-нибудь одной связи в исходном пептиде после аргинина или лизина, таким образом, получатся следующие пептиды:
Ala-Leu-Gly-Lys-Ala-Arg-Gly-Gly-Lys
Arg-Ala-Leu-Gly-Lys
Ala-Arg-Gly-Gly-Lys
Arg-Ala-Leu-Gly-Lys-Ala-Arg
Gly-Gly-Lys
и аминокислота аргинин.
Гидролиз может быть неполным, если его остановить, убрав ферментативную активность. Для этого, например, можно 1) добавить вещество, инактивирующее фермент, или 2) разрушить сам фермент, а) изменив рН добавлением кислоты, либо б) нагреванием.
Вопрос 3.
Нет, трипсин не будет гидролизовать связи после модифицированного лизина, поскольку в узнавании субстрата ферментом важны именно боковые группы аминокислот, в том числе их размер и заряд. А при модификации изменяется и то, и другое.
Вопрос 4.
а) реакция лизина с динитрофторбензолом будет протекать как по α-, так и по ε-аминогруппе:
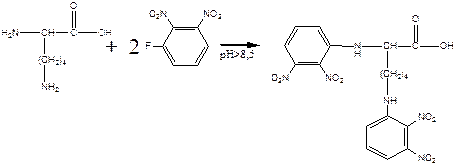
б) реакция лизина с альдегидами приводит к образованию основания Шиффа и тоже протекает по двум аминогруппам:
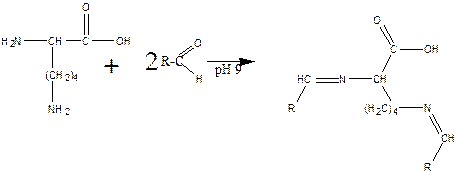
в) реакция с малеиновым ангидридом в слабощелочной среде:
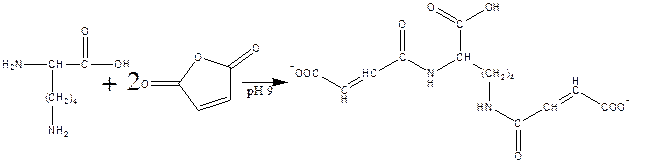
г) реакция с C2H5-S-CO-CF3, S-этил-трифторацетатом:
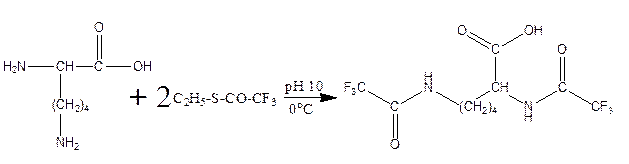
д) реакция карбамоилирования:
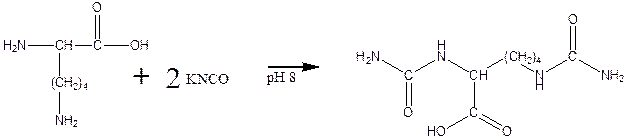
е) реакция гуанидирования:
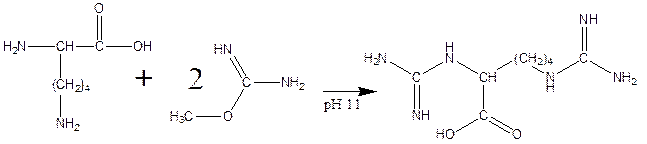
Вопрос 5.
После модификации лизинов фермент перестает их «узнавать», поэтому состав полученных пептидов изменится, и будет выглядеть следующим образом:
Ala-Leu-Gly-Lys-Ala-Arg-Gly-Gly-Lys
Arg-Ala-Leu-Gly-Lys-Ala-Arg
Gly-Gly-Lys
и аминокислота аргинин.
Вопрос 6.
Исходя из того, что трипсин гидролизует связи после аргинина и лизина, в его центр связывания могут входить аспарагиновая кислота или глутаминовая кислота, отрицательно заряженные боковые группы которых будут образовывать электростатические контакты с положительно заряженными боковыми группами субстрата.
Вопрос 7.
Поскольку вещество А дает реакцию серебряного зеркала, значит это альдегид. С учетом известной доли углерода, и предполагая, что число атомов углерода при реакции не изменилось, можно рассчитать молекулярную массу вещества А: M (A) = 12·8/0,7164 = 134 (г/моль). Следовательно, это не просто альдегид, а дикарбонильное соединение, то есть фенилглиоксаль:
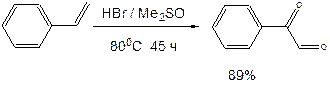
При взаимодействии фенилглиоксаля с аргинином, карбонилы реагируют с гуанидо-группой аргинина:
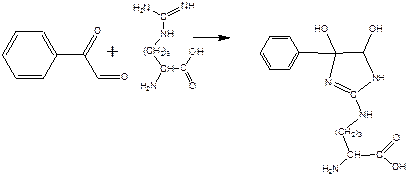
получающееся вещество не очень устойчиво, и его можно стабилизировать добавлением борной кислоты:
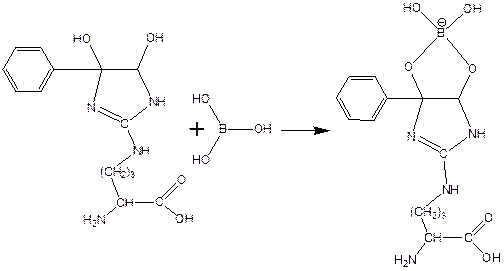
Система оценивания:
Вопрос 1а). 1 балл
Вопрос 1б). 2 балла
Вопрос 2а).2 балла
Вопрос 2б). 1 балл
Вопрос 3. 1 балл
Вопрос 4. 6 баллов, по одному баллу за каждую реакцию
Вопрос 5. 2 балла
Вопрос 6. 2 балла
Вопрос 7. 3 балла
Итого 20 баллов
 2015-04-12
2015-04-12 311
311







