1. Обратимость химических реакций, химическое равновесие.
2. Циклопарафины. Циклоалканы.
3. Задача. На полное гидрирование 5,4 г некоторого алкина расходуется 4,48 л водорода (н. у.) Определите молекулярную формулу данного алкина.
1. Обратимость химических реакций, химическое равновесие.
Реакции, протекающие при данных условиях во взаимно противоположных направлениях, называются обратимыми.
N2 + 3H2 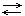 2NH3 + Q
2NH3 + Q
Одну из реакций называют прямой, другую обратной. В таких реакциях концентрация реагирующих веществ уменьшается, следовательно, уменьшается скорость прямой реакции. При этом скорость обратной реакции постепенно увеличивается, наступает химическое равновесие, при котором скорость прямой реакции равна скорости обратной реакции. Это значит: сколько молекул образуется в единицу времени, столько и расходуется.
Состояние химического равновесия при неизменных условиях сохраняется длительное время. При изменении условий (t, давления (P) и концентрации (C)) состояние равновесия нарушается. Смещение химического равновесия определяется по принципу Ле Шателье: если на систему находящуюся в равновесии оказывать какое-либо воздействие, то равновесие смещается в направление ослабления этого воздействия.
Если реакции идёт с выделением тепла, то при повышении t равновесие смещается в направление «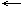 » и наоборот «
» и наоборот «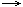 ».
».
[Если + Q и t 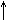 , то
, то 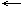 ]
]
Если с уменьшением объёма (V), то при повышении давления (P) равновесие смещается в направлении 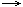 и наоборот
и наоборот 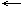 .
.
N2 + 3H2 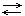 2NH3 + Q
2NH3 + Q
1V 3V 2V
всегда к меньшему объёму, если V 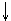
При увеличении концентрации (C) исходных веществ равновесие смещается в сторону 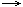 прямой реакции и наоборот
прямой реакции и наоборот 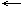 .
.
[Если С 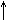 , то
, то 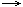 ]
]
если увел. С прод. реакции, то 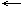
если умен. С прод. реакции, то 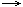
 2015-04-17
2015-04-17 1323
1323
