Отдельные газы или многокомпонентные системы могут находиться в одно-, двух- и трехфазном состоянии (в газообразном, жидком или твердом). Индивидуальные газы изменяют свой объем в зависимости от давления и температуры. Если вещество находится в однофазном состоянии, то его объем V определяют по температуре Т и давлению Р.

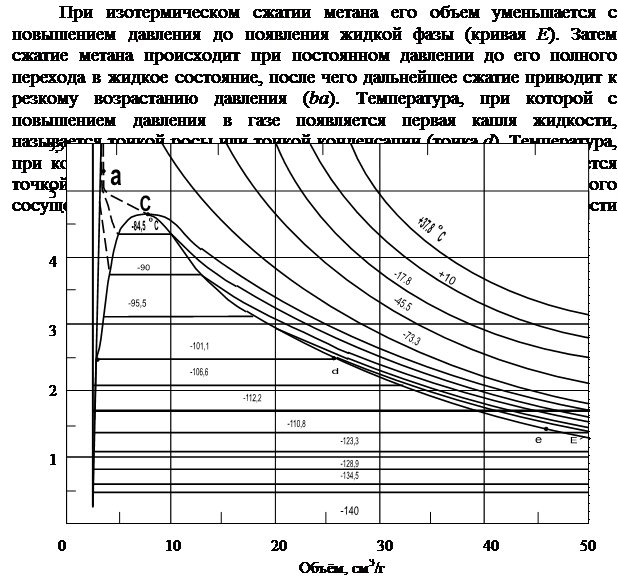
На рис. 2.4 приводится диаграмма давление–удельный объем для метана.
Рис. 2.4. Диаграмма Р-V для метана
сти паров. Для однокомпонентных систем точка росы, точка насыщения, упругость паров соответствуют одному и тому же давлению и температуре, поэтому линия параллельна оси удельного объема. Из этого рисунка следует, что линия bc есть геометрическое место точек насыщения, а линия cde – геометрическое место точек росы. Точка С, в которой встречаются эти линии, называется критической. В этой точке различие между газообразной и жидкой фазами исчезает. Критической точке С соответствуют критические давление и температура.
Таким образом, максимальная температура, при которой данный газ еще может быть переведен в жидкое состояние, называется критической температурой, а соответствующее ей давление называется критическим давлением. Критическая температура метана равна -82,10С, для этана +32,30С, для азота +141,70С. Внутри области bcde имеем сосуществующие газообразную и жидкую фазы. Правее линии cde – газообразная фаза, левее линии bc – жидкая фаза.
 2015-04-17
2015-04-17 941
941








