Впервые с позиций квантовой механики природу сил в молекуле водорода объяснили В. Гейтлер и Ф. Лондон в 1927 г. Они осуществили приближенный расчет на основании уравнения Шредингера и нашли зависимость потенциальной энергии системы, состоящей из двух атомов водорода, от расстояния между их ядрами. Они выяснили, что результаты расчета зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов.
При одинаково направленных параллельных спинах (рис. 3.1) энергия системы из двух сближающихся атомов непрерывно возрастает за счет сил отталкивания, т. е. связь между атомами водорода НА и НВ не возникает, поскольку известно, что устойчивая молекула может образоваться только при условии уменьшения потенциальной энергии системы.
При взаимодействии атомов с антипараллельными спинами (направленными в противоположные стороны, рис. 3.1) энергия системы уменьшается и достигает минимума при расстоянии между атомами водорода rо = 0,74 Å, образуется молекула водорода, для которой это и есть длина связи.
Минимум на энергетической кривой показывает момент образования химической связи, сопровождающийся уменьшением энергии системы. При дальнейшем сближении атомов нарастают силы взаимного отталкивания ядер атомов водорода, что вызывает увеличение энергии.
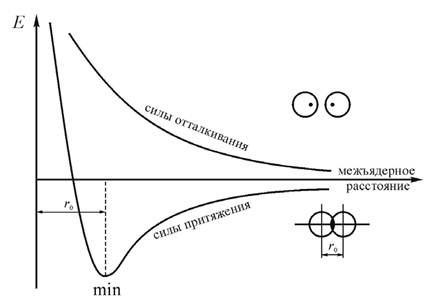
Рис. 3.1. Изменение энергии системы при сближении двух атомов водорода
Итак, одно из условий образования ковалентной связи - противоположная направленность спинов электронов взаимодействующих атомов.
 2015-04-01
2015-04-01 884
884








