Ковалентная связь
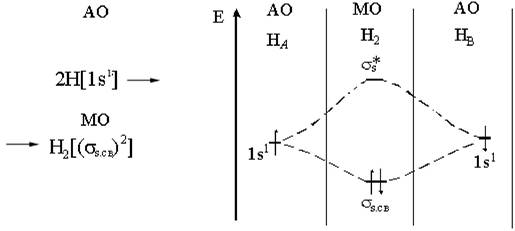
|
Рис. 3.2. Энергетическая диаграмма образования молекулы водорода по методу молекулярных орбиталей
По методу молекулярных орбиталей образование молекулы возможно только в том случае, если число электронов на связывающей орбитали больше, чем на разрыхляющей. В противном случае молекула не образуется, т. к. нет выигрыша энергии. Кратность связи В определяют по формуле
Число связывающих электронов - Число разрыхляющих электронов
В=.
2-0 Рассчитаем кратность связи в молекуле водорода В = =1, т. е. связь
2 осуществляется одной электронной парой. Кратность связи равна единице.
Насыщаемость и направленность ковалентной связи,
 2015-04-01
2015-04-01 397
397








