Поскольку при подведении тепла Qv в изохорном процессе изменение объема газа не происходит (V = const), то в уравнении
Qv = А + ΔU работа А = 0.
Тогда переход системы из исходного состояния 1 в конечное состояние 2 можно описать уравнением
Qv = U2 - U i = ΔU,
т. е. подводимое тепло в изохорном процессе полностью расходуется на изменение внутренней энергии системы от начального состояния ΣΔUисх сост до конечного ΣΔUкон. сост:
ΔU = ΣΔUкон.
ΣΔUисх. сост-
Реакции, протекающие с выделением тепла, называются экзотермическими, а с поглощением тепла – эндотермическими.
На рис. 5.2 приведены графики изменения энтальпии в эндо- и экзотермических реакциях, из которых видно, что в экзотермических реакциях энтальпия (теплосодержание) убывает, т. е. ∆Н < 0, а в эндотермических реакциях энтальпия возрастает, т. е. ∆Н > 0.
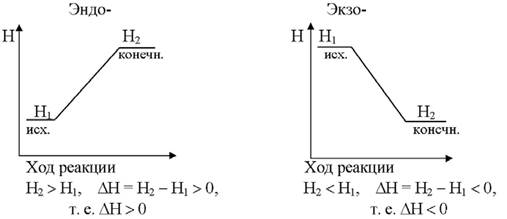 |
Рис. 5.2. Изменение энтальпии в экзотермической и эндотермической реакциях
Изменение энтальпии, измеренное в стандартных условиях (давление 101,3 кПа, температура 298 К) называется стандартной энтальпией ∆Н0298.
Данные по стандартным энтальпиям соединений приводятся в справочных таблицах и находят большое применение при различных термохимических расче-
тах.
Энтальпия образования вещества - это тепловой эффект реакции образования 1 моль сложного вещества из простых. Энтальпия образования вещества, измеренная в стандартных условиях, называется стандартной эн-
 2015-04-01
2015-04-01 1314
1314
