тальпией образования, обозначается ΔН0обр 298, часто индекс 298 опускается. Например, стандартная энтальпия образования молекул воды равна
А Н
обр Н2О(пар)
= -241,84 кДж/моль.
Энтальпия образования простых веществ равна нулю:
∆Н
обр Н2,О2,N2...
= 0.
В основе термохимических расчетов лежит закон, открытый русским ученым Г. И. Гессом в 1840 г. Закон Гесса гласит: тепловой эффект реакции зависит от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути перехода (из начального состояния в конечное).
Или иначе: тепловой эффект реакции равен алгебраической сумме тепловых эффектов всех его промежуточных стадий, т. е.
∆Н = ∆Н1 + ∆Н2.
Например, рассмотрим процесс получения диоксида углерода СО2 из графита, представив его в виде ряда последовательных реакций, каждая из которых сопровождается своим тепловым эффектом (изменением энтальпии):
 С(графит) + 1/2О2(г) = СО(г) ∆Нi
С(графит) + 1/2О2(г) = СО(г) ∆Нi
СО(г)+1/2О2(г)= СО2(г) ∆Н2
Или суммарно:
С(графит) ~"~ О2(г) ~~ СО2(г)
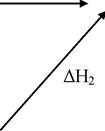
Представим эти реакции в виде схемы:
ΔН
С(графит)
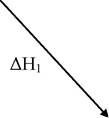
СО(г)
I стадия,
II стадия.
∆Н.
СО2(г)
Очевидно,
ΔН = ΔНi + ΔН2 или ΔНi + ΔН2 + (-ΔН) = 0.
 2015-04-01
2015-04-01 566
566








