Процесс десульфурации можно представить уравнением реакции:
[S] + (CaO) = (CaS) + [O]
Константа равновесия реакции равна: kp = 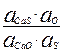 (1)
(1)
В результате можно записать:
[S] = 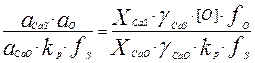 (2)
(2)
Выразим значение XCaS - мольную долю сульфида кальция в шлаке через концентрацию серы, тогда XCaS = 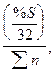 (3)
(3)
где 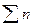 - сумма молей компонентов шлака - CaO, CaS, SiO2, Ai2O3 и др. в 100 г. шлака. Подставляя выражение (3) в ур-ние (2) получим:
- сумма молей компонентов шлака - CaO, CaS, SiO2, Ai2O3 и др. в 100 г. шлака. Подставляя выражение (3) в ур-ние (2) получим:
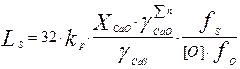 (4)
(4)
В результате логарифмирования ур-ния (4) получаем:
lg LS = lg 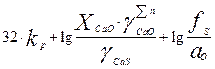 (5)
(5)
В этом ур-нии первое слагаемое является величиной постоянной при неизменной температуре, второе слагаемое определяется основностью шлака, а третье - активностью кислорода и коэффициентом активности серы в расплаве.
При рафинировании простых, не легированных сталей можно принять значение fS = 1 и ур-ние (5) запишется в виде:
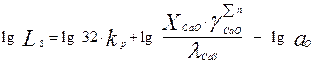 (6)
(6)
При экспериментальном изучении распределения серы между жидким металлом и шлаками системы CaO - MgO - Al2O3 - SiO2 для коэффициента распределения серы LS получили эмпирическое уравнение, имеющее ту же структуру, что и уравнение (6)
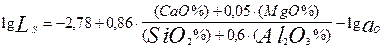 (7)
(7)
Эффективность процесса десульфурации обычно оценивают степенью десульфурации - 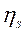 (в долях)
(в долях) 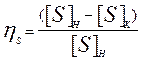 . Выведем соотношение между LS и
. Выведем соотношение между LS и 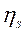 . Для этого запишем два уравнения:
. Для этого запишем два уравнения:
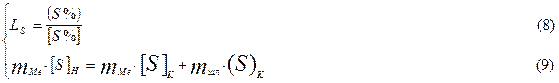
где: mме и mшл массы металла и шлака при обработке стали в ковше.
Из ур-ния (9) получаем:
mме×([S]H - [S]K) = mшл×(S)K = mшл×LS×[S]K. (9)
Поделив выражение в уравнении (9) на [S]H получим:
mме 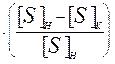 = mшл×LS
= mшл×LS 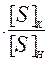 (10)
(10)
Введем в ур-ние (10) величину кратности шлака 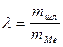 (в долях) тогда получаем из ур-ния (10):
(в долях) тогда получаем из ур-ния (10): 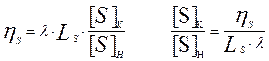
Принимая 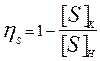 , имеем:
, имеем: 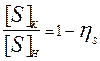 ; и тогда:
; и тогда: 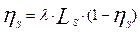 ; или
; или 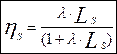 (11)
(11)
Таким образом соотношение между 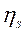 и LS имеет вид:
и LS имеет вид: 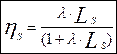 (12) (в долях или в процентах при умножении на 100).
(12) (в долях или в процентах при умножении на 100).
Из анализа ур-ния (7):
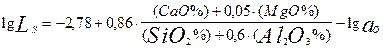
следует, что величина LS - коэффициента распределения серы между рафинировочным шлаком и металлом определяется в основном двумя факторами:
а) основностью шлака 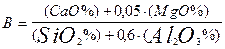
б) активностью кислорода в металле в процессе рафинирования шлаком в ковше.
Существенное влияние на величину LS должна оказывать величина aO. Учитывая, что одновременно с рафинированием стали шлаком происходит процесс ее раскисления ферромарганцем, ферросилицием и алюминием, необходимо предварительно рассчитать значение aO в раскисленном металле. При получении конструкционного металла элементом, определяющим величину aO в стали является алюминий, содержание которого для этого класса сталей составляет в среднем 0,05 %. По величине KAl=[Al%]2×[aO]3 можно рассчитать равновесную с алюминием активность кислорода - aO. Однако, при этом необходимо иметь в виду, что используемое для расчета aO значение KAl будет различным при обработке в ковшах с различной огнеупорной футеровкой; что было установлено экспериментально с использованием кислородных зонтов для измерения активности кислорода [1]. Результаты этих исследований представлены в таблице № 1.
Таблица 1
Значения KAl=[Al]2×[aO]3
| Кислая, шамотная футеровка | Высокоглиноземистая, смолодоломитовая | |||
| без SiCa | с добавкой SiCa | без SiCa | с добавкой SiCa | |
| Величина KAl | 10-12 | 10-12,5 | 10-13 | 10-13,5 |
Ниже представлены расчеты коэффициента распределения серы при обработке стали в сталеразливочных ковшах синтетическими шлаками и ТШС.
 2015-04-01
2015-04-01 512
512








