1. Определяем молярную массу минерала.
М (Mg3(OH)2[AlSi3O10] = 24×3+2(16+1)+27+28×3+16×10 = 377 г.
2. Рассчитываем процентное содержание каждого элемента, входящего в состав минерала (массовую долю ω, %) принимая молярную массу магниевой слюды за 100 %.
377 г минерала составляют 100 %
24 г Mg –«– –«– –«– Х
ω (Mg), % = Х = 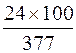 = 6,37 %.
= 6,37 %.
Так как атомов магния в минерале 3, то процентное содержание всего магния составит 6,37×3 = 19,1 %.
Аналогично рассчитывается процентное содержание каждого элемента.
ω (О), % = 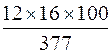 = 50,9 %;
= 50,9 %;
ω (Н), % = 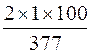 = 0,5 %;
= 0,5 %;
ω (Al), % = 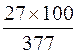 = 7,2 %;
= 7,2 %;
ω (Si), % = 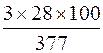 = 22,3 %.
= 22,3 %.
Ответ: % содержание элементов (массовая доля) в магниевой слюде составляет: Mg – 19,1; О – 50,9; Н – 0,5; Al – 7,2; Si – 22,3.
Пример 4.2. Для повышения плодородия почвы на площади 4 га требуется внесение удобрения в виде сульфата аммония (NH4)2SO4. Рассчитайте массу азота, полученного почвой при норме внесения сульфата аммония 0,025 кг/м2.
 2015-04-06
2015-04-06 1141
1141








