1. Напишем уравнение реакции осаждения трехвалентного хрома гидроксидом кальция:
2Cr3+ + 3Ca(OH)2 = 2Cr(OH)3 + Ca2+.
2. Рассчитаем количество трехвалентного хрома, содержащегося в 1 м3 (или 1000 л) раствора. Составляем пропорцию:
2,5 моль Cr3+ содержится в 1 л раствора
Х –«– –«– –«– –«– в 1000 л раствора
Х = 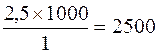 моль.
моль.
3. Рассчитаем количество молей Са(ОН)2, необходимых для полного осаждения трехвалентного хрома. Из уравнения реакции следует:
на 2 моля Cr3+ приходится 3 моля Са(ОН)2
на 2500 молей Сr3+ приходится Х молей Са(ОН)2
Х = 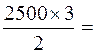 3750 молей Са(ОН)2.
3750 молей Са(ОН)2.
4. Рассчитываем массу гидроксида кальция, необходимого для осаждения Cr3+:
1 моль Са(ОН)2 весит 74 г
3750 молей Са(ОН)2 весят Х г
Х = 3750×74 = 277500 г = 277,5 кг.
Задача 3.1. Определите вид сточной воды (кислая или щелочная), если концентрация ионов ОН- равна (моль/л).
| Вариант | [ОН-], моль/л | Вариант | [ОН-], моль/л |
| 4×10-3 | 2,3×10-3 | ||
| 5,8×10-8 | 3,5×10-13 | ||
| 0,2×10-7 | 8,4×10-6 | ||
| 4,7×10-2 | 0,5×10-2 | ||
| 3,6×10-5 | 5,6×10-1 | ||
| 7×10-4 | 6×10-3 | ||
| 2×10-6 | 2,8×10-10 | ||
| 0,5×10-7 | 7,8×10-6 | ||
| 8,2×10-3 | 6×10-8 | ||
| 3,5×10-2 | 5×10-10 | ||
| 9×10-7 | 4×10-12 | ||
| 5,3×10-6 | 6,9×10-9 | ||
| 8×10-11 | 7×10-5 | ||
| 4,5×10-5 | 9,5×10-4 | ||
| 2,5×10-3 | 5,7×10-11 |
Задача 3.2. Определите соответствие санитарно-токсикологи-ческим нормам воды в водоеме, если в водоем вместимостью (А) с дождевыми водами объемом (В) занесено (Д) кг удобрения, исполь-зуемого на полях.
| Вариант | Удобрение | Объем водоема (А), м3 | Объем дождевых вод (В), м3 | Количество занесенных удобрений (Д), кг |
| Сульфат аммония ((NH4)2SО4) | 1,5 | |||
| Хлористый аммоний (NH4Cl) | 2,0 | |||
| Аммиачная селитра (NH4NO3) | 1,0 | |||
| Кальциевая селитра (Са(NО3)2) | 1,8 | |||
| Хлористый калий (KCl) | 2,0 | 3,5 | ||
| Сульфат аммония ((NH4)2SО4) | 1,5 | |||
| Хлористый аммоний (NH4Cl) | 2,0 | |||
| Аммиачная селитра (NH4NO3) | 1,0 | |||
| Кальциевая селитра (Са(NО3)2) | 1,8 | |||
| Хлористый калий (KCl) | 2,0 | 3,5 | ||
| Сульфат аммония ((NH4)2SО4) | 1,5 | |||
| Хлористый аммоний (NH4Cl) | 2,0 | |||
| Аммиачная селитра (NH4NO3) | 1,0 | |||
| Кальциевая селитра (Са(NО3)2) | 1,8 | |||
| Хлористый калий (KCl) | 2,0 | 3,5 | ||
| Сульфат аммония ((NH4)2SО4) | 1,5 | |||
| Хлористый аммоний (NH4CI) | 2,0 | |||
| Аммиачная селитра (NH4NO3) | 1,0 | |||
| Кальциевая селитра (Са(NО3)2) | 1,8 | |||
| Хлористый калий (KCl) | 2,0 | 3,5 | ||
| Сульфат аммония ((NH4)2SО4) | 1,5 | |||
| Хлористый аммоний (NH4Cl) | 2,0 | |||
| Аммиачная селитра (NH4NO3) | 1,0 | |||
| Кальциевая селитра (Са(NО3)2) | 1,8 | |||
| Хлористый калий (KCl) | 2,0 | 3,5 | ||
| Сульфат аммония ((NH4)2SО4) | 1,8 | |||
| Хлористый аммоний (NH4CI) | 2,5 | |||
| Аммиачная селитра (NH4NO3) | 1,5 | |||
| Кальциевая селитра (Са(NО3)2) | 2,8 | |||
| Хлористый калий (KCl) | 2,5 | 3,5 |
Задача 3.3. Для очистки сточной воды от токсичного шести-валентного хрома Cr (VI) в виде K2Cr2O7 с концентрацией с моль/л в качестве восстановителя использовали реагент. Напишите уравнение реакции и рассчитайте количество реагента, необходимого для полного восстановления Cr (VI), находящегося в объеме V м3 электролита.
| Вариант | Реагент | с (K2Cr2O7) моль/л | Вариант | Реагент | с (K2Cr2O7) моль/л |
| SO2 | 0,5 | Na2SO3 | 2,5 | ||
| FeSO4 | 1,0 | SO2 | 3,5 | ||
| Na2SO3 | 1,3 | FeSO4 | 0,8 | ||
| FeSO4 | 1,7 | Na2SO3 | 3,7 | ||
| Na2SO3 | 2,3 | SO2 | 8,2 | ||
| SO2 | 4,5 | FeSO4 | 4,2 | ||
| FeSO4 | 5,8 | Na2SO3 | 5,6 | ||
| Na2SO3 | 0,6 | SO2 | 0,7 | ||
| SO2 | 0,9 | FeSO4 | 6,0 | ||
| FeSO4 | 1,5 | Na2SO3 | 5,7 | ||
| Na2SO3 | 2,0 | SO2 | 0,9 | ||
| SO2 | 1,4 | FeSO4 | 7,0 | ||
| FeSO4 | 5,5 | Na2SO3 | 2,6 | ||
| Na2SO3 | 4,6 | SO2 | 3,4 | ||
| SO2 | 7,0 | FeSO4 | 5,5 |
Задача 3.4. При электролизе сточной воды объемом 1,5 м3 на катоде выделился металл. Определите: силу тока, прошедшего через раствор (варианты 1-7), количество электричества, необходимое для электролиза сточной воды (варианты 8-15), массу металла выделившегося на катоде (варианты 16-21), электрохимический эквивалент металла (варианты 22-25), время электролиза (варианты 26-30).
| Вариант | I, A | τ | Me n + | m, г | η, % |
| - | 2 ч | Ni2+ | |||
| - | 40 с | Cu2+ | 1,5 | ||
| - | 2,5 ч | Co2+ | |||
| - | 35 с | Cd2+ | |||
| - | 15 ч | Fe2+ | |||
| - | 50 мин | Bi3+ | |||
| - | 5 ч | Zn2+ | |||
| - | - | Ni2+ | |||
| - | - | Y3+ | |||
| - | - | Hg+ | |||
| - | - | Ta5+ | |||
| - | - | Al3+ | |||
| - | - | Cu+ | 0,253 | ||
| - | - | Pb2+ | 345,5 | ||
| - | - | Fe3+ | 65,5 | ||
| 20 мин | Cu2+ | - | |||
| 1,5 ч | Co2+ | - | |||
| 40мин | Cd2+ | - | |||
| 45 мин | Ni2+ | - | |||
| 60 с | Pb2+ | - | |||
| 2 ч | Cd2+ | - | |||
| 25 мин | - | ||||
| 1,6 ч | - | ||||
| 65 мин | - | ||||
| 120 мин | - | ||||
| - | Сu+ | ||||
| - | Ni2+ | 540,5 | |||
| - | Co2+ | ||||
| - | Pb2+ | ||||
| - | Cd2+ | 130,9 |
Задача 3.5. Рассчитайте массу гидроксида кальция Ca(OH)2 необходимого для полного осаждения иона тяжелого металла, содержащегося в ванне гальванического производства объемом V м3.
| Вариант | Men+ | c (Me), моль/л | V, м3 | Вариант | Men+ | c (Me), моль/л | V, м3 |
| Ni2+ | 0,5 | 0,5 | Cu2+ | 2,5 | 1,0 | ||
| Cu2+ | 1,0 | 1,0 | Co2+ | 3,5 | 0,8 | ||
| Co2+ | 1,3 | 1,2 | Mn2+ | 0,8 | 0,6 | ||
| Cd2+ | 1,7 | 1,1 | Ni2+ | 3,7 | 1,2 | ||
| Fe2+ | 2,3 | 1,3 | Pb2+ | 8,2 | 1,5 | ||
| Cr3+ | 4,5 | 1,4 | Cd2+ | 4,2 | 1,4 | ||
| Mn2+ | 5,8 | 0,9 | Nb5+ | 5,6 | 1,1 | ||
| Ni2+ | 0,6 | 1,5 | Al3+ | 0,7 | 0,5 | ||
| Y3+ | 0,9 | 1,0 | Cd2+ | 6,0 | 1,3 | ||
| Cu+ | 1,5 | 1,1 | Cr3+ | 5,7 | 0,9 | ||
| Ni2+ | 2,0 | 1,2 | Сu+ | 0,9 | 0,8 | ||
| Al3+ | 1,4 | 1,3 | Ni2+ | 7,0 | 1,0 | ||
| Cu+ | 5,5 | 1,4 | Co2+ | 2,6 | 1,2 | ||
| Pb2+ | 4,6 | 0,8 | Pb2+ | 3,4 | 1,3 | ||
| Fe3+ | 7,0 | 0,7 | Cd2+ | 5,5 | 1,4 |
 2015-04-06
2015-04-06 2665
2665
