Пример 5.1. При абсорбции SO2 известковым молоком (Са(ОН)2) поглощено 0,64 кг SO2. Сколько л известкового молока израсходовано, если концентрация его 10 % (масс.), а плотность 1,12 г/мл?
Решение
Записываем уравнение реакции:
SO2 + Ca(OH)2 = CaSO3 + H2O.
По уравнению реакции 1 моль SO2 реагирует с 1 молем Са(ОН)2. Рассчитываем молярные массы участников реакции:
М(SO2) = 32 + 2×16 = 64 г/моль;
М(Са(ОН)2) = 40 + 2×16 + 2×1 = 74 г/моль.
0,64 кг SO2 составляет: 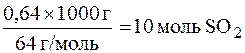 .
.
Значит количество необходимого Са(ОН)2 тоже составляет 10 моль, т. е. 740 г.
Рассчитываем массу известкового молока:
в 100 г раствора содержится 10 г Са(ОН)2
в Х -«- -«- -«- -«- 740 г
Х = 7400 г.
Рассчитываем объем израсходованного известкового молока:
V = 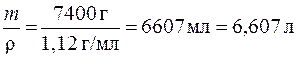 .
.
Пример 5.2. Какой объем промышленного газа, содержащего 15 % (объем.) оксида углерода подвергнуто каталитической очистке, если получено 1,5 м3 метана (н.у.)?
 2015-04-06
2015-04-06 1645
1645








