Вода является очень слабым электролитом. Она диссоциирует по уравнению:
H2O 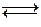 H+ + OH-.
H+ + OH-.
Для данного обратимого процесса можно написать выражение:
Kd (H2O) = 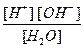 = 1,8 × 10-16 (при 22 °С).
= 1,8 × 10-16 (при 22 °С).
В данном выражении [H2O] равна концентрации молекул воды, не распавшихся на ионы. Так как на ионы распадается ничтожно малая часть молекул (a (H2O) = 1,8 × 10-7), то величину [H2O] можно считать постоянной и равной молярной концентрации чистой воды:
[H2O] = 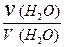 = 55,56 моль / дм3 = 55,56 М.
= 55,56 моль / дм3 = 55,56 М.
Полученное значение можно умножить на константу диссоциации и получить новую константу, которая называется константа воды (К):
K = [H2O] × Kd = 55,56 × 1,8 × 10-16» 1 × 10-14.
Константа воды определяет равновесные концентрации ионов Н+ и ОН- в водном растворе при данной температуре:
K = [H+] × [OH-] = 10-14 (при 22 °С).
Константа воды зависит только от природы воды и температуры. При охлаждении она уменьшается (К (5 °С) = 2,1 × 10-15), а при нагревании увеличивается (К (60 °С) = 1,3 × 10-13).
В чистой воде [H+] = [OH-] = 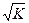 = 10-7 M. Такая среда называется нейтральной.
= 10-7 M. Такая среда называется нейтральной.
В водных растворах, содержащих кислоты [H+] > 10-7 M, а [OH-] < 10-7 M. Такая среда называется кислой. В растворах, содержащих основание [H+] < 10-7M, а [OH-] > 10-7M. Такая среда называется щелочной.
Для удобства пользуются не самими значениями концентраций ионов [H+] и [ОН-], а их отрицательными десятичными логарифмами, которые называются водородным показателем (рН) и гидроксильным показателем (рОН):
pH = - lg [H+],
pOH = - lg [OH-].
В нейтральной среде рН = 7.
В кислой среде рН < 7, pOH > 7.
В щелочной среде рН > 7, pOH < 7.
Если прологарифмировать уравнение [H+] [OH-] = 10-14, то можно показать, что рН + рОН = 14.
Характер среды в данном растворе можно качественно оценить с помощью специальных реактивов, которые называются кислотно-основными индикаторами. Примером такого индикатора являются лакмус: при рН < 5 он имеет красный цвет, в интервале 5 £ рН £ 8 - фиолетовый цвет, а при рН > 8 - синий цвет.
Точное определение рН (или рОН) растворов осуществляется специальными приборами (рН- метрами).
 2015-04-30
2015-04-30 2046
2046








