Аккумуляторами называются называются гальванические элементы, предназначенные для многократного использования. При заряде аккумулятора реагенты регенерируют в результате пропускания через систему электрического тока от внешнего источника в направлении, обратном направлению тока при разряде.
Способность к регенерации обеспечивают подбором таких реагентов, которые в окисленной и восстановленной формах трудно растворимы в жидкости, находящейся между электродами. Поэтому продукты электрохимических реакций осаждаются на тех же электродах, на которых они образуются. В результате не происходит смешивания этих продуктов и нарушения целостности электродов.
Большое практическое значение имеет свинцовый аккумулятор, состоящий из нескольких одинаковых ячеек. Устройство ячейки свинцового аккумулятора изображено на рисунке:
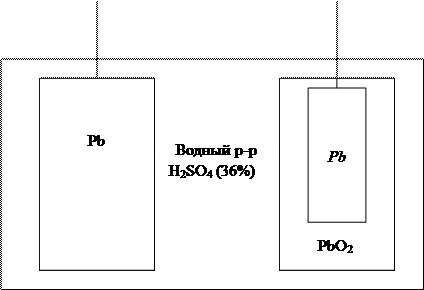 |
При работе свинцового аккумулятора (разряде) на электродах идут процессы:
анод (-) Pb + SO4-2 + 2e-= PbSO4
катод (+) PbO2 + 4H+ + SO4-2 + 2 e- = PbSO4+ 2H2O.
ЭДС этой системы при комнатной температуре около 2 В.
Для зарядки через аккумулятор пропускают постоянный электрический ток (на катод подается положительный потенциал, на анод - отрицательный). При этом на электродах протекают те же полуреакции, но в обратном направлении.
 2015-04-30
2015-04-30 420
420








