Теоретические основы. Скорость химической реакции можно рассматривать как изменение количеств реагирующих или образующихся в процессе реакции веществ за единицу времени. Если реакция проходит при постоянном объеме, то ее скорость можно описать как изменение молярных концентраций веществ в единицу времени.
v = 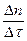 =
= 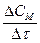
Скорость химической реакции зависит от различных факторов: природы реагирующих веществ, их концентрации, степени измельчения (для гетерогенных реакций), температуры реакционной смеси, присутствия катализаторов.
Зависимость скорости реакции от концентрации реагирующих веществ. Скорость химической реакции пропорциональна концентрациям реагирующих веществ (закон действия масс). Для простой одностадийной реакции
а А + b B 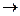 с С
с С
v = k C 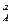 C
C 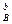 ,
,
где k - константа скорости реакции, определяющая скорость реакции при концентрациях реагирующих веществ, равных 1 моль/л. Константа скорости зависит от природы реагирующих веществ и от температуры.
СА, СВ - концентрации газообразных или растворенных веществ (концентрации твердых и жидких реагентов - постоянные величины, их значения включаются в величину константы скорости реакции и отдельно не записываются).
Зависимость скорости реакции от температуры. При увеличении температуры на 10° скорость реакции увеличивается в 2-4 раза (правило Вант Гоффа).
v2 = v1 g 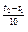 ,
,
где v2 и v1 - скорости реакций при температурах t2 и t1;
g - температурный коэффициент скорости, определяет изменение скорости реакции при изменении температуры на 10°.
Химическое равновесие. Если химическая реакция может протекать только в одном направлении, то она называется необратимой. Реакции, протекающие одновременно в двух направлениях, обратимы. С течением времени скорость прямой реакции (v 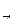 ) уменьшается, а скорость обратной реакции (v
) уменьшается, а скорость обратной реакции (v 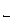 ) увеличивается до тех пор, пока они не становятся равными. В системе устанавливается химическое равновесие. Условие химического равновесия: v
) увеличивается до тех пор, пока они не становятся равными. В системе устанавливается химическое равновесие. Условие химического равновесия: v 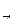 = v
= v 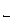 .
.
Состояние химического равновесия описывается константой равновесия, К. Для обратимой химической реакции
a A + b B 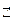 c C + d D
c C + d D
K = 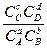 ,
,
где CA, CB, CC, CD - концентрации газообразных или растворенных веществ.
Состояние химического равновесия - динамическое. Его можно смещать. Смещение химического равновесия подчиняется принципу Ле Шателье (принципу противодействия): еcли на систему, находящуюся в состоянии химического равновесия, оказывается внешнее воздействие (изменяются температура, давление, концентрация одного из исходных веществ или продуктов реакции), то положение равновесия смещается в ту сторону, которая ослабляет внешнее воздействие.
Увеличение температуры вызывает смещение равновесия в сторону протекания эндотермической реакции (DH>0), а уменьшение температуры - в сторону экзотермической реакции (DH<0).
Увеличение давления в системе вызывает смещение равновесия в сторону меньшего количества газообразных веществ, а уменьшение давления - в сторону большего количества газообразных веществ.
Увеличение концентрации одного из исходных веществ вызывает смещение равновесия реакции вправо (в сторону его расходования, то есть в сторону образования продуктов реакции), а увеличение концентрации одного из продуктов реакции - влево.
Цель работы. Экспериментальное подтверждение закона действия масс (установление зависимости скорости реакции от концентрации реагирующих веществ) и закона Вант Гоффа (определение величины температурного коэффициента скорости реакции).
Порядок работы.
Опыт 1. Зависимость скорости реакции от концентрации
 2015-04-30
2015-04-30 984
984








