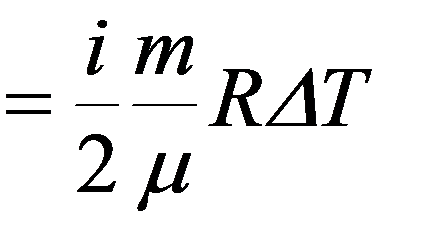
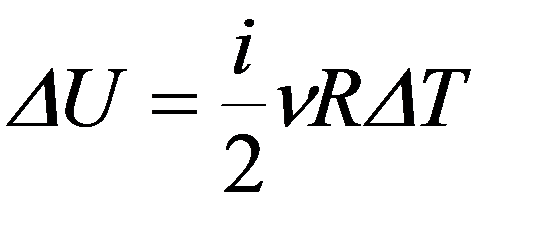
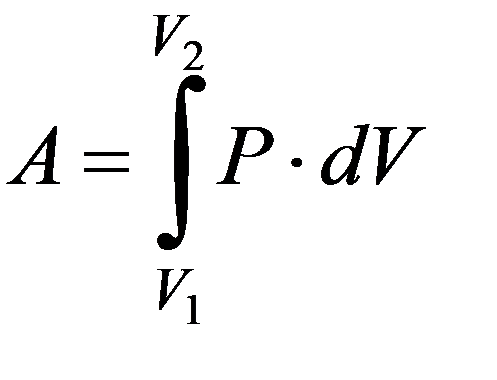
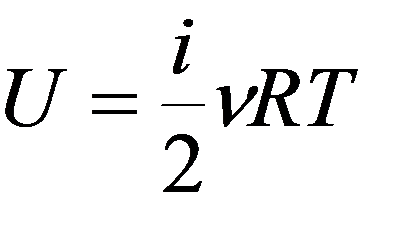
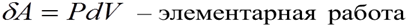
V 2 > V 1 система совершает работу
V 2 < V 1 над системой совершают работу
V 2 = V 1 система не совершает работу
Работа газа зависит от пути перехода из состояния 1 в состояние 2 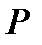
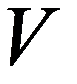
ü Работа не является функцией состояния
ü 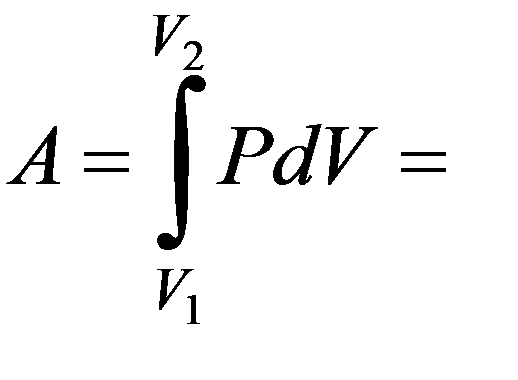 Сила давления газа является неконсервативной
Сила давления газа является неконсервативной
Изобарный процесс Р = const
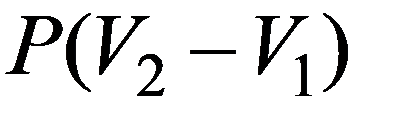
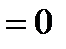
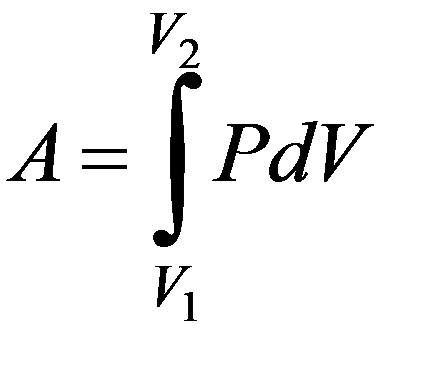 Изохорный процесс V = const
Изохорный процесс V = const
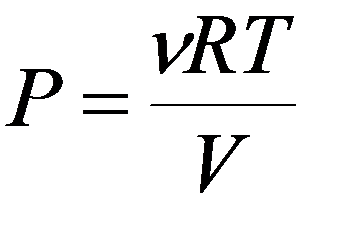
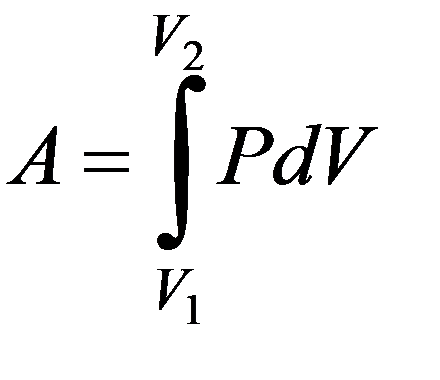
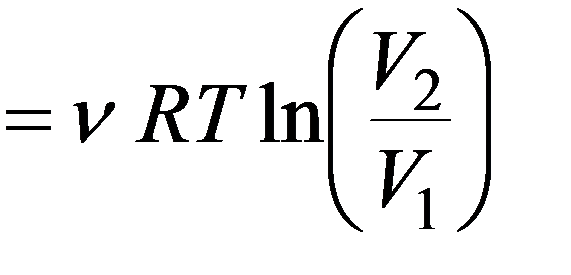
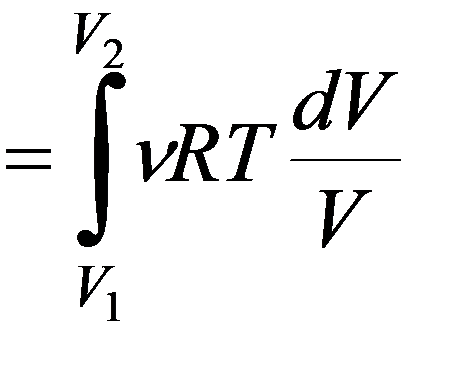
Изотермический процесс T = const
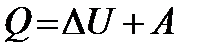 Закон сохранения энергии, в котором учитывается особая форма передачи энергии путем теплопередачи, является фундаментальным законом физики и называется первым началом термодинамики:
Закон сохранения энергии, в котором учитывается особая форма передачи энергии путем теплопередачи, является фундаментальным законом физики и называется первым началом термодинамики:
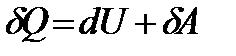 Количество тепла, полученное системой, расходуется на приращение внутренней энергии системы и на совершение системой работы над внешними телами (системами). – дифференциальная форма первого начала термодинамики
Количество тепла, полученное системой, расходуется на приращение внутренней энергии системы и на совершение системой работы над внешними телами (системами). – дифференциальная форма первого начала термодинамики
По форме обмена энергией можно выделить три вида систем:
1. изолированные (dQ =0, dA =0)
1) теплоизолированные (адиабатические) (dQ =0, dA ¹0)
2) тепловые резервуары (dA =0, dQ ¹0)
Теплопередача – это процесс обмена энергией с окружающими телами, при котором изменяются только внутренние параметры термодинамической системы.
Способы теплопередачи теплопроводность конвекция излучение
Мерой энергии, переданной при теплопередаче, является количество теплоты Q. Эта величина, как и работа, не является полным дифференциалом (зависит от процесса).
Q > 0 – система получает тепло
Q < 0 – система отдает тепло
14) Удельная и молярная теплоёмкости. Теплоёмкости при постоянном давлении и объёме. Связь между теплоёмкостями.
Полная теплоемкость тела или системы – скаляр-ная физическая величина, характеризующая процесс теплообмена и равная количеству тепла, полученному термодинамической системой для изменения его температуры на один Кельвин:
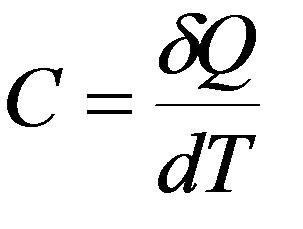
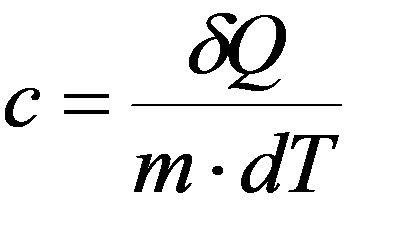
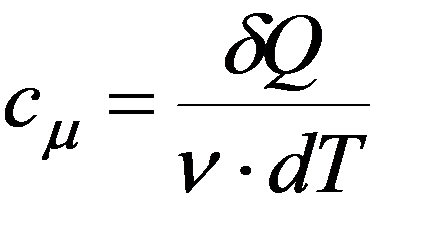
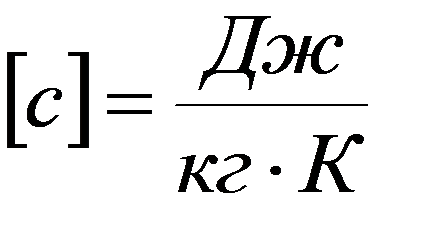
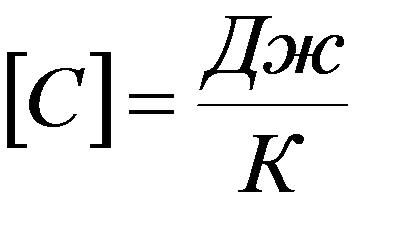
Удельная теплоемкость – скалярная физическая величина, равная количеству тепла, необходимому для нагревания единицы массы газа на один Кельвин:
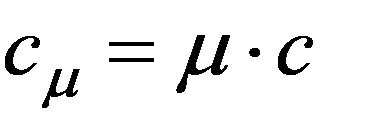 Молярная теплоемкость - скалярная физическая величина, равная количеству тепла, необходимому для нагревания одного моля газа на один Кельвин:
Молярная теплоемкость - скалярная физическая величина, равная количеству тепла, необходимому для нагревания одного моля газа на один Кельвин:
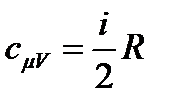
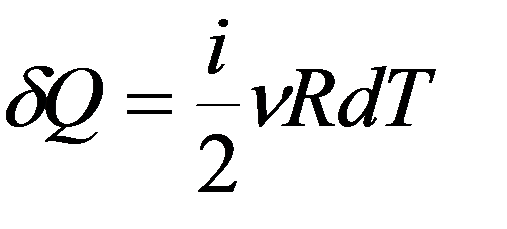 – связь молярной и удельной теплоемкости
– связь молярной и удельной теплоемкости
Теплоемкость при постоянном объеме V = const
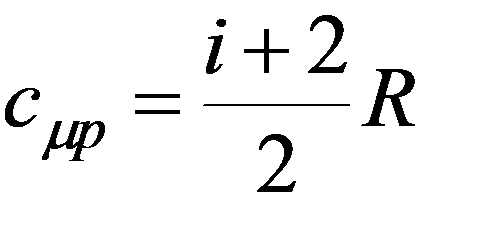
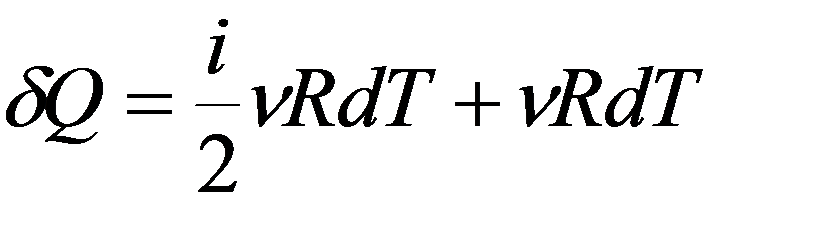 Молярная теплоемкость при постоянном объеме:
Молярная теплоемкость при постоянном объеме:
Теплоемкость при постоянном давлении P = const
Молярная теплоемкость при постоянном давлении:
уравнение Майера коэффициент Пуассона
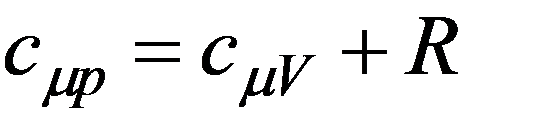
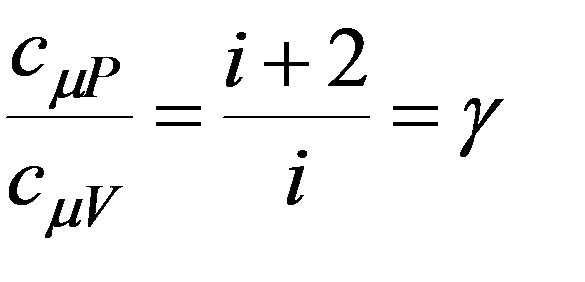
15)Адиабатный процесс. Уравнения адиабатного процесса. Энтропия, её смысл и свойства. II начало термодинамики.
Адиабатный процесс – это процесс протекающий без теплообмена с окружающей средой.
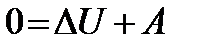
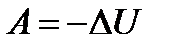
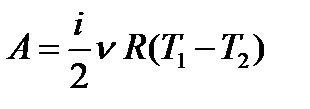
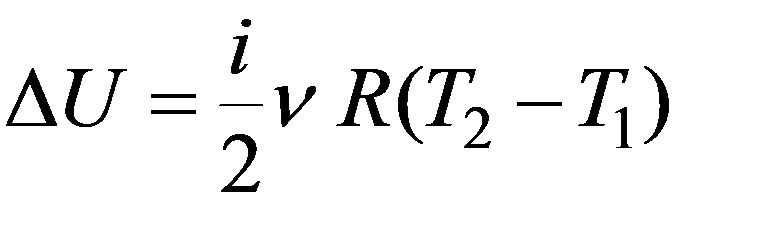 Работа совершается за счет убыли внутренней энергии
Работа совершается за счет убыли внутренней энергии
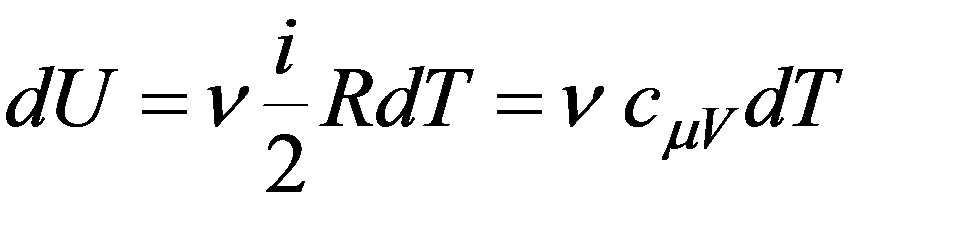
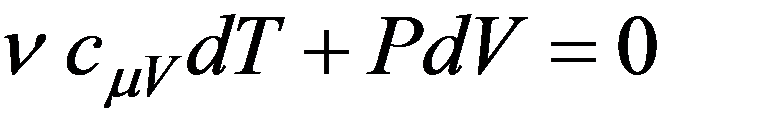
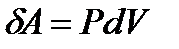
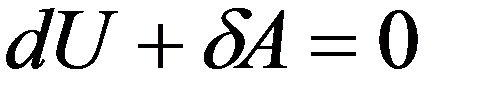 При адиабатном расширении газ охлаждается
При адиабатном расширении газ охлаждается
 2015-04-30
2015-04-30 1012
1012
