1. В молекулах алифатических соединений, содержащих сопряженные связи, а также в ароматических молекулахвзаимное влияние атомов осуществляется преимущественно другим путем, качественно отличающимся отиндукционного взаимного влияния атомов. Для того чтобы уяснить характер такого влияния, рассмотрим, например, свойства систем с сопряженными двойными связями в жирных соединениях.
Среди химических особенностей систем с двумя сопряженными двойными связями наиболее характерным является протекание реакций 1,4-присоединения. В таких реакциях атакующие молекулы или их части (ионы, радикалы) присоединяются к крайним (первому и четвертому) атомам сопряженной системы, причем между вторым и третьиматомами возникает новая двойная связь, например:
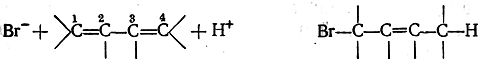
Кроме того, в целом такие системы более реакционноспособ-ны (в первую очередь за счет повышенной реакционной способности первого и четвертого атомов) и могут вступать в реакции, не свойственные молекулам с изолированными двойными связями. Таково восстановление систем
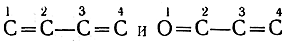
водородом в момент выделения, присоединение к системам С=С—С=С щелочных металлов и ихметаллоорганических соединений, присоединение анионов CN-, SO3H- и R- (при действии RMgX) к четвертому (углеродному) атому системы О=С—С=С и др.
Таким образом, химические свойства сопряженных систем показывают, что содержащиеся в них двойные связиотличаются от изолированных двойных связей. Это отличие обусловлено особым характером взаимного влияния ненасыщенных атомов сопряженных систем. Такой специфический вид взаимного влияния атомов, качественно отличный от индукционного влияния, может быть интерпретирован как результат взаимодействия π-электронов двух или нескольких сопряженных двойных связей. Вследствие этого такой вид взаимного влияния атомов предложено называть сопряжением связей.
Молекулы с сопряженными двойными связями характеризуются и некоторыми физическими особенностями, например повышенной энергией образования сравнительно с молекулами, имеющими изолированные двойные связи, некоторым выравниванием межатомных расстояний и высокой поляризуемостью электронной системы связей. Физические показатели такого рода характеризуют строение нереагирующей молекулы, а следовательно, Они указывают на то, что сопряжение двойных связей представляет собой фактор, находящий свое отражение и в нереагирующей молекуле. Результат сопряжения связей в нереа-лирующей молекуле предложено называть статическим эффектом сопряжения или мезомерным эффектом.
Как мы уже указывали, природу сопряжения двойных связей можно интерпретировать как результат большой подвижности π-электронов, смещение которых происходит во всей сопряженной системе в делом. Роль π-злектронной пары одной из связей сопряженной системы может играть необобщенная пара р-электронов такихатомов, как N, О, S и т. п. Для того чтобы отразить этот вид взаимного влияния в структурных формулах, смещения π-электронов обычно отмечают изогнутыми стрелками, проведенными, например, от кратной связи С = С к простой связи С—С или от атома с неподеленной парой р-электронов к простой связи в направлении смещения:

Рассмотрим в качестве примера молекулу ацетамида, в которой неподеленная пара электронов атома азотанаходится в
сопряжении с π-связью:
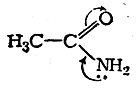
Распределение электронной плотности в молекуле ацетамида определяется конкуренцией атомов О и N в соответствии с их сродством к электрону. Смещение неподеленной пары электронов атома азота к атому углеродакарбонильной группы является причиной понижения основных свойств аминогруппы ацетамида сравнительно саминогруппой в амине
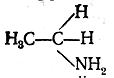
и вместе с тем причиной понижения электрофильной реакционной способности карбонильной группы (точнее —атома углерода этой группы) сравнительно, например, с карбонильной группой в альдегидах:
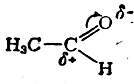
Этот пример ясно показывает, что под термином «сопряжение связей» в сущности понимается определенного рода взаимодействие электронных систем атомов, в первую очередь такое взаимодействие, в котором участвуют валентные электроны.
Представления о сопряжении связей являются дальнейшим развитием проблемы взаимного влияния атомов в молекулах. С их помощью удается уже в настоящее время понять и объединить большой круг явлений органической химии, казавшихся ранее совершенно обособленными и загадочными.
Необходимо еще раз отметить, что сопряжение связей следует понимать как проявление определенного рода взаимного влияния атомов.
Представления о сопряжении связей позволяет вскрыть характер взаимного влияния атомов и систематизировать имеющийся фактический материал. Было бы глубоко ошибочным отрывать вопрос сопряжения связей от проблемы взаимного влияния атомов.
Химическая связь есть только форма взаимодействия ато-моз и, естественно, не может рассматриваться независимо от самих атомов.
ОПРЯЖЕНИЕ СВЯЗЕЙ (конъюгация связей), чередование простых и кратных связей в структурной ф-ле соед. (напр., в 1,3-бутадиене СН2=СН—СН=СН2). В широком смысле понятие сопряжение связей охватывает также гомосопряжение (в альтернирующую последовательность простых и двойных связей включается один или большее число sp 3-гибридизованных атомов. например соед. ф-лы I), спиросопряжение (в ненасыщ. спирановых структурах, например II), сверхсопряжение (гиперконъюгация)-сопряжение кратных (или группы простых) связей с группой s-связей одного атомного центра; III, IV.
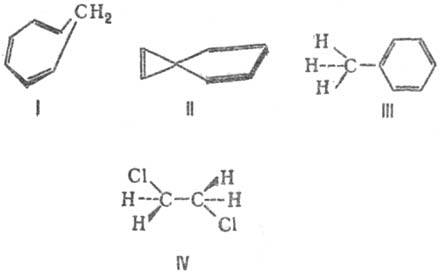
Расширение толкования С. с. связано также с представлениями о сопряжении не только неск. связей, но и кратных (или простых) связей с любым атомным центром-как обладающим одним электроном или неподеленной электронной парой(С-, О, NR2 и др., например V), так и центром с вакантной орбиталью (С+, В, А1 и др., например VI и VII). Структурная единица, содержащая сопряженные связи, наз. сопряженной системой.
<p.Квантовая химия рассматривает сопряжение связей как взаимод. между орбиталями отдельных фрагментов молекулы, которое может осуществляться по тому или иному механизму. Напр., s-сопряжению соответствует взаимод. орбиталей простых связей, p-сопряжению - взаимод. орбиталей кратных связей. s-C. с. всегда присутствует в любой молекуле, состоящей из трех или большего числа атомов. В то же время наблюдаемые свойства полиенов и аннуленов описываются исходя из представлений как s-, так и p-сопряжения.
сопряжение связей не обязательно означает неприменимость модели локализованных связей к рассматриваемой молекуле. Так, электронная заселенность локализованных мол. орбиталей вне s-связей не превышает 1%. Так же хорошо локализованы и p-связи в сопряженных неароматич. системах (особенно когда учитывается альтернирование связей). Так, в линейных полиенах заселенность вне двухцентровых связей ок. 2%. Такие сопряженные системы описываются одной резонансной структурой со связями только между соседними атомами и без разделения формальных зарядов (см. Резонанса теория), а их коллективные свойства удается рассматривать в рамках аддитивных моделей.
В то же время в ароматич. и некоторых др. системах, которые наилучшим образом описываются суперпозицией резонансных структур и где доли локализованных мол. орбиталей имеют большие веса вне связей (напр., в бензоле ок. 13%), сопряжение связей обычно отождествляется с делокализацией связей. Экспериментально наблюдаемые коллективные свойства таких сопряженных систем в принципе нельзя представить в виде аддитивных ф-ций свойств связей.
Наиб. существенной особенностью сопряженных систем с делокализованными связями является их повыш. термо-динамич. устойчивость. В ароматич. системах теплоты образования значительно выше, чем значения, найденные с учетом аддитивности локальных параметров, а связи характеризуются полной выравненностью длин (см. Ароматичность). Количеств. мера повыш. термодинамич. устойчивости таких систем-энергия резонанса (сопряжения, дело-кализации). В сопряженных системах правилам аддитивности не подчиняются также параметры ЙК спектров, величины дипольных моментов и поляризуемости, диамагнитной восприимчивости и др. В этих случаях при расчете разл. характеристик вводят поправочные члены экзальтации и т.п.
Наличием сопряжение связей объясняют характерное изменение геометрии молекулы - укорочение формально простых и удлинение формально кратных связей. Напр., в полиенах длины простых связей С—С (0,151 нм) несколько укорочены по сравнению с длиной связи С—С в этане (0,154 нм). Количеств. мера изменения длин связей при сопряжении порядки связей между атомами: в 1,3-бутадиене порядки связей альтернируют (соотв., 1,894; 1,447; 1,894), а в аллильном катионе порядки связей между соседними атомами С равны.
Сопряженные системы с делокализованными связями представляют собой соед. с характсристич. электронными переходами, причем с удлинением цепи сопряжения повышается интенсивность и смещается поглощение в электронных спектрах в сторону больших длин волн (соотв. гипер-хромный эффект и батохромный сдвиг; см. Цветность органических соединений).
Понятие о сопряжение связей используют при рассмотрении реакц. способности. Напр., электроф. присоединение к сопряженным диенам (см. Диеновые углеводороды)приводит к смеси продуктов 1,2- и 1,4-присоединения.
В простейшем случае сопряженные системы —
это системы с чередующимися двойными и одинарными связями. Они могут быть открытыми и закрытыми. Открытая система имеется в диеновых углеводородах (УВ).
Все атомы С находятся в состоянии sp-гибридиза-ции. Четыре негибридные р-орбитами, перекрываясь между собой, образуют единую электронную систему. Этот вид сопряжения называется p, p-сопряжением.
Происходит сопряжение р-электронов с S-электро-нами. Этот вид сопряжения называется р, р-сопряже-нием. Закрытая система имеется в ароматических УВ.
Сопряжение – процесс энергетически выгодный, энергия (Е) при этом выделяется. Энергия сопряжения бутадиена – 1,3 составляет 15 кДж/моль, энергия сопряжения бензола – 228 кДж/моль.
2. Ароматичность
Это понятие, включающее различные свойства ароматических соединений. Условия ароматичности:
1) плоский замкнутый цикл;
2) все атомы С находятся в sp2-гибридизации;
3) образуется единая сопряженная система всех атомов цикла;
4) выполняется правило Хюккеля: в сопряжении участвуют 4n + 2 р-электронов, где n = 1, 2, 3...
Простейший представитель ароматических углеводородов – бензол. Он соответствует всем четырем условиям ароматичности. Правило Хюккеля: 4n + 2 = 6, n = 1.
Нафталин – ароматическое соединение 4n + 2 = 10, n = 2.
Пиридин – ароматическое гетероциклическое соединение. Взаимное влияние атомов в молекуле
2. Коллигативные свойства – это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара растворителя над раствором,
2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей.
3) осмотическое давление.
1 закон Рауля. Давление насыщенного пара растворителя над раствором пропорционально мольной доле растворителя.
2 закон Рауля. Понижение температуры замерзания и повышение температуры кипения растворов по сравнению с таковыми для чистого растворителя пропорциональны моляльной концентрации растворенного вещества:
Закон Вант-Гоффа. Осмотическое давление раствора равно газовому давлению, которое производило бы растворенное вещество, находясь в газообразном состоянии и занимая объем, равный объему раствора.
 2015-04-30
2015-04-30 610
610