Д) сохранения массы веществ
4. Если два элемента образуют между собой несколько различных соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как простые целые числа – закон:
а) Авогадро
Б) кратных отношений
в) эквивалентов
г) сохранения массы веществ
д) постоянства состава веществ
5. В равных объемах различных газов при одинаковых условиях содержится одинаковое число частиц. Это формулировка соответствует закону:
а) Ломоносова
Б) Авогадро
в) Дальтона
г) Рихтера
д) Фарадея
6. Каждое химически чистое вещество имеет постоянный качественный и количественный состав – закон:
А) постоянства состава веществ
б) сохранения массы веществ
в) постоянства массы веществ
г) постоянства эквивалентов веществ
д) постоянства соотношения масс атомов в молекуле
7. Реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных или ионно-обменных реакциях или одному электрону в окислительно-восстановительных реакциях называется:
а) молекулой
б) атомом
в) эквивалентом
г) изотопом
д) изобарой
8. Сколько атомов водорода содержится в 5,6л метана при н.у.:
а) 6,02∙10 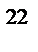
б) 1,5∙10 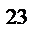
в) 6,02∙10 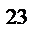
г) 3,01∙10 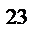
д) 0,375∙10 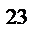
9. Объем при н.у., который занимает углекислый газ, массой 22 г:
а) 22,4 л
б) 11,2 л
в) 5,6 л
г) 44,8 л
д) 33,6 л
10. Количество вещества, содержащее 1,8∙10 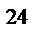 молекул углекислого газа:
молекул углекислого газа:
а) 0,3 моль
б) 30 моль
в) 3 моль
г) 1,3 моль
д) 1 моль
11. Определите фактор эквивалентности гидроксида железа(III) в реакции:
Fe(OH) 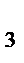 + 2HCl → Fe(OH)Cl
+ 2HCl → Fe(OH)Cl 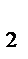 + 2H2O
+ 2H2O
а) 1
б) 1/2
в) 1/3
г) 2
д) 0,25
12. Молярная масса эквивалентов оксида алюминия равна:
а) 102 г/моль
б) 51 г/моль
в) 25,5 г/моль
г) 34 г/моль
д) 17 г/моль
13. Молярная масса эквивалентов гидроксида кальция равна:
а) 74 г/моль
б) 37 г/моль
в) 18,5 г/моль
г) 24,7 г/моль
д) 14,8 г/моль
14. Молярная масса эквивалентов ортофосфорной кислоты по уравнению реакции 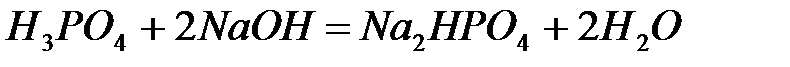 равна:
равна:
а) 98 г/моль
б) 32,7 г/моль
в) 49 г/моль
г) 14 г/моль
д) 19,6 г/моль
15. Молярная масса эквивалентов ортофосфорной кислоты по уравнению реакции 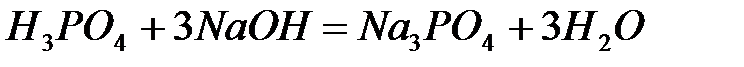 равна:
равна:
а) 98 г/моль
б) 32,7 г/моль
в) 49 г/моль
г) 14 г/моль
д) 19,6 г/моль
16. Молярная масса эквивалентов перманганата калия при восстановлении его в кислой среде до ионов марганца в степени окисления +2 равна:
а) 158 г/моль
б) 79 г/моль
в) 52,67 г/моль
г) 31,6 г/моль
д) 39,5 г/моль
17. Молярная масса эквивалентов перманганата калия при восстановлении его в нейтральной среде до оксида марганца в степени окисления +4 равна:
а) 158 г/моль
б) 79 г/моль
в) 49 г/моль
г) 52,67 г/моль
д) 31,6 г/моль
18. Молярная масса эквивалентов перманганата калия при восстановлении его в щелочной среде до манганата калия равна:
а) 158 г/моль
б) 79 г/моль
в) 52,67 г/моль
г) 31,6 г/моль
д) 39,5 г/моль
19. Молярная масса эквивалентов металла в оксиде составляет 56,2 г/моль. Молярная масса эквивалента оксида составляет:
а) 48,2 г/моль
б) 72,2 г/моль
в) 88,2 г/моль
г) 64,2 г/моль
д) 28,1 г/моль
20. 0,493г хлорида металла после обработки нитратом серебра образовали 0,861г хлорида серебра. Молярная масса эквивалентов металла равна:
а) 46,67 г/моль
б) 48,72 г/моль
в) 45,59 г/моль
г) 49,34 г/моль
д) 43,48 г/моль
21. Каждое химически чистое вещество имеет постоянный качественный и количественный состав – закон:
 2015-04-30
2015-04-30 646
646







