5.2.5.1. Методы контрпульсации.
Физиологическая сущность методов КП заключается в уменьшении систолического давления в левом или правом желудочке сердца за счет функционирования механического устройства, способного за счет аспирации крови насосом в пресистолу снизить конечное диастолическое давление в аорте или легочной артерии (рисунок 5.19). Во время диастолы сердца за счет изгнания аспирированной крови насосом или раздувания НБ повышается диастолическое артериальное давление, повышается коронарный перфузионный градиент, что способствует увеличению коронарного кровотока и раскрытию коронарных коллатералей.
В последующим принцип артерио-артериальной КП был реализован в 2-х вариантах: периферическом и центральном. При последнем, насос подключался непосредственно к аорте или брахиоцефальному стволу.
В течение 50 - 60-х годов метод периферийной КП был детально исследован в экспериментах и применен в клинической практике (H.Soroff с соавт., 1964; P.Hah-nloser с соавт., 1968; W.Birtwell, 1967; М.Я.Руда, 1966). Причем клинический опыт оказался не столь благоприятным, как результат экспериментов. Среди прочего, неудачи клинического применения периферической КП были связаны с ограниченной длительностью КП из-за опасности развития ишемии конечности и травмы крови, и невысокой эффективности.
Поэтому делались попытки обойти эти препятствия путем подключения насоса к различным отделам грудной аорты (Kantrowitz A., 1969, В.И.Шумаков с соавт., 1969), подкрыльцовой артерии (В.И. Бураковский с соавт., 1970 и т.д.)
Гемодинамическая эффективность КП с грудной аорты резко повышалось. Так, по данным сотрудника НИИТ и ИО А.Касымова, в 1980 г. проводившего сравнительное изучение гемодинамики при периферической и центральной КП, при центральном подключении систолическое давление в левом желудочке снизилось почти на 50%, тогда как при периферической КП, этот показатель снизился на 13%. Аналогично изменились и другие показатели кардиогемодинамики, включая коронарный кровоток.
В частности, работа левого желудочка сердца при центральной КП уменьшалось на 36%, против 5% при проведении КП с бедренной артерии.
Но и центральное подключение насоса, улучшив эффективность вспомогательного кровообращения, не уменьшило число осложнений, таких как, гемолиз и тромбоэмболии, что позволило высказать мнение о том, что методы артерио-артериальной КП являются бесперспективными в клиническом плане, тем более что в 1962 г. был предложен метод внутриаортальной КП насосом-баллончиком (Moulopulos S., Topaz S., Kolff W.).
Однако, экспериментальные работы греческих ученых (Nanas S. с соавт., 1997), а также их клинический опыт использования бесклапанного насоса - контрпульсатора объемом 100 мл, подключенного к восходящему отделу аорты, у больных, ожидавших трансплантацию сердца, показали, что применение современных материалов, систем управления открывают новые возможности применения метода центральной контрпульсации.
В результате у одного больного с терминальной стадией сердечной недостаточности спустя 54 суток центральной контрпульсации состояние настолько улучшилось, что ему удалось провести успешную трансплантацию сердца. Преимущества метода по сравнению с ВАКП и ОЛЖ авторы видят в его более высокой гемодинамической эффективности, малой травматичности подключения и отключения насоса, и незначительной опасности тромбоза (из-за отсутствия механических клапанов).
Подводя итог краткому обзору применения ВАКП, следует отметить, что в истории применения ВАКП прослеживается несколько периодов:
а) 1968—1975 г.г. ВАКП применялась для лечений осложнений ОИМ (A.Kantrowitz, D.Bregman, В.И.Шумаков с соавт., 1968 г.);
6) 1975 — 1980 г.г. ВАКП кроме указанных выше случаев стала использоваться для отключения больных от АИК при посткардиотомной ОСН (G.Cooper с соавт., 1977 г.);
в) современный этап, когда ВАКП редко применяется при ОИМ с кардиогенным шоком, при посткардиотомной ОСН гемодинамические критерии ее применения значительно расширены и основным показателем к ВАКП стали ишемические поражения миокарда без гемодинамических признаков сердечной недостаточности (S.Christenson с соавт., 2000 г.).
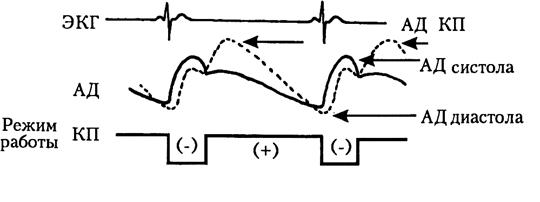
Рис. 5.19. Изменениекривой аортального давления при проведении контрпульсации (пунктирная линия).
5.2.5.2. Обход сердца с помощью насосов мембранного типа.
В конце 1960 годов в США и СССР начинаются разработки и испытания мембранных насосов. На рис.5.20 показан современный промышленный мембранный насос «Ясень» (Россия) с объемом рабочей камеры 100 см3. Он состоит из корпуса 1, двух тарельчатых клапанов 2 и 3, с седлами 4 и 5 на подводящей 6 и отводящей 7 магистралях. Эластичная мембрана 8 разделяет воздушную полость управления 9 и рабочую полость 11. Через воздушный трубопровод 10 осуществляется управление насосом созданием давления или вакуума в полости 9 от внешнего компрессора и вакуум - насоса. Следует отметить, что применение насосов мембранного типа требует высокой квалификации персонала, особенно в управлении работой насоса, которая обычно проводится в кардиосинхронизированном режиме. Наличие клапанов на входе и выходе повышает риск развития тромбоэмболических осложнений, и вызывают травму крови. Для подключения мембранных насосов к сердцу и сосудам необходимо использовать магистрали большого диаметра, что связано с дополнительной хирургической травмой. Несмотря на свои недостатки, мембранные насосы являются пока единственными устройствами, которые могут применяться при длительном использовании (более года), так как вызывают, особенно насосы с биоклапанами, низкую травму крови и создают пульсирующий кровоток.
Система «Novacor VAS» (Baxter Healthcare Corporation, Oakland, CA, USA) была создана в 1979 г. Она предназначена для полного обхода только левого желудочка сердца. Мировой опыт применения Novacor® LVAS с 1993 по 2000 г. насчитывает более 850 случаев. Из них более 110 пациентов с поддержкой системой более 6 месяцев, 30 – более года, у нескольких пациентов система проработала более 4 лет.
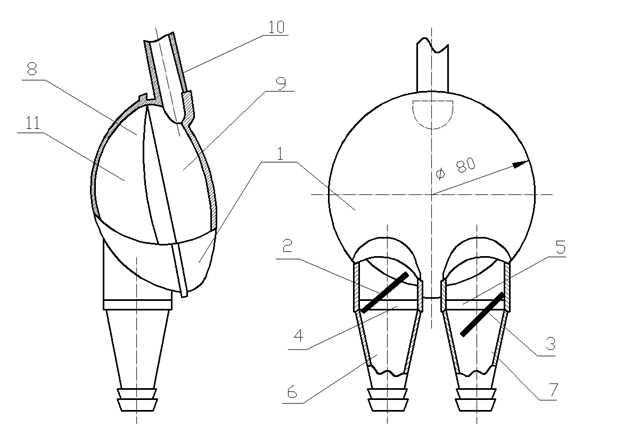
Рис. 5.20. Мембранный насос «Ясень».

Рис.5.21. Имплантируемая часть «Novacor VAS»
Система состоит из имплантируемой, переносной (носимой) и стационарной частей. Имплантируемая часть (рис.5.21.) представлена насосом мембранного типа с электромеханическим соленоидным приводом, обеспечивающим производительность выброса крови 3-10 л/мин, и двумя армированными дакроновыми кондуитами (приточный и отточный), снабженными биологическими ксеноаортальными клапанами диаметром 21-25 мм. Наружная носимая часть включает портативный контроллер, соединенный с насосом кабелем, и две батареи. Стационарной частью является монитор искусственного левого желудочка сердца с программным обеспечением, находящийся в клинике, и персональный монитор пациента, который располагается у него дома. Принцип действия основан на фазовом электромеханическом воздействии рычагов соленоида на упругоэластичную рабочую камеру насоса.
Еще один насос объемного типа: «Thoratec VAD» (Thoratec Laboratories, Berkeley, CA, USA). Его клинические исследования проводятся с 1988 г. «Thoratec VAD» - это пневматическая система пульсирующего типа для обхода левого, правого или обоих желудочков вместе. Насос состоит из двух камер, разделенных полиуретановой мембраной на две полости для воздуха и крови, что обеспечивает минимальную травматизацию форменных элементов крови. (рис. 5.4). Внутренние поверхности кровяной камеры и канюль сделаны из биосовместимого материала «Тhоrаlоn» на основе полиуретана, как и трехстворчатые клапаны. При максимальном ударном объеме 65 мл данная система может быть использована у пациентов с весом 22-144 кг, при поверхности тела 0,8-2,5 м2, что позволяет широко применять это устройство у пациентов с левожелудочковой и тотальной сердечной недостаточностью, требующих как кратковременной, так и длительной поддержки. Требует применения малых доз гепарина и низкомолекулярных декстранов, при длительном использовании – варфарина. Выживаемость при использовании «Thoratec VAD» составляет 58 –74 % пациентов, у 27% больных СВК было успешно отключено. Ведущее место среди осложнений занимают кровотечения (32% при тотальном обходе сердца, 10% при обходе ЛЖ), на втором месте – инфекция, связанная с имплантацией насоса (13%), на третьем – тромбоэмболии (5%). На рисунке 5.24 представлен внешний вид насоса «Thoratec VAD».
Система «HeartMate VE-LVAS» (Thermal Cardiosystems, Inc, Woburn, MA, USA) - предназначена для поддержки работы только левого желудочка и представлена насосом, кабелем, контроллером и двумя батареями. Все поверхности, контактирующие с кровью, покрыты составом, индуцирующим образование тонкой псевдонеоинтимы. Насос приводится в действие электрической системой HeartMate VE-LVAS (с 1991 г.) Состоит из двух камер, разделенных гибкой полиуретановой диафрагмой, одна из которых предназначена для электрического мотора и выталкивающей пластины, а другая (рабочая) для циркуляции крови. Подключение происходит по схеме: «верхушка левого желудочка – восходящая аорта». Сам насос размещается в сформированном кармане мышц передней брюшной стенки.
Объем заполнения камеры насоса - 90 мл, эффективный и максимальный ударный объем - 83 мл, он способен обеспечивать поток крови свыше 10 л/мин. Полный вес устройства составляет 680 г. Имеется положительный опыт применения системы в качестве альтернативы ТС длительностью более 5 мес. Наиболее частое осложнение – инфекция (42%). Используются лишь антитромбоцитарные препараты, при этом отмечается малое количество тромбоэмболических осложнений при применении устройства. Внешний вид устройства представлен на рисунке 5.25.
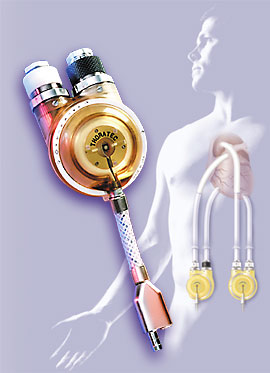
Рис. 5.24. Внешний вид насоса «Thoratec VAD».
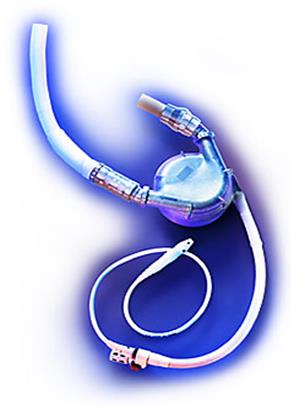
Рис. 5.25. Внешний вид насоса «HeartMate VE-LVAS».
В 1988 г. была представлена паракорпоральная пневматическая система «Abiomed BVS 5000», предназначеная для бивентрикулярного обхода. В основе – двухкамерный пульсирующий насос с пневматическим приводом, полиуретановые трехстворчатые клапаны между камерами и на выходе из «желудочка», электронный блок управления. Все поверхности, контактирующие с кровью, выполнены из полиуретанового материала «Angioflex». Возможные осложнения такие же, как и для других СВК пульсирующего типа. Прежде всего, это инфекция, поскольку имеется прямой путь распространения ее по канюлям, а так же нарушения свертывающей системы крови (кровотечения и тромбоэмболии), механические неполадки устройства. В настоящее время количество пациентов, получавших поддержку сердца системой «Abiomed BVS 5000» уже перевалило за 3000, а максимальный срок ее работы – более 160 дней.
В таблице приведены сравнительные характеристики мембранных насосов различных моделей.
Таблица
| Тип устройства | «Абиомед» | «Торатек» | «Новакор», «ХартМейт»* | «Ясень 19» |
| Показания | Посткардиотомия ОСН | Посткардиотомия ОСН и «мост» к ТС | «Мост» к ТС | «Мост», по- сткардиотомная ОСН |
| Расположение насоса | Наружное | Наружное | Имплантируемое | Наружное |
| Поддержка желудочков сердца | Левый, правый или бивентрику- лярный | Левый, правый или бивентри- кулярный | Только левый | Левый и правый |
| Рост пациента | Маленький-высокий | Средний-высокий | Высокий | Высокий |
| Средняя длительность перфузии | Средняя | От средней до продолжительной | Продолжительная | Средняя |
| Источник энергии | Пневматический | Пневматический | Электрический | Пневматический |
| Антикоагулянты | Да | Да | Да/Нет | Да |
| Носимость устройства | Нет | Нет | Да | Нет |
| Выписка больных с устройством | Нет | Нет | Да | Нет |
* Примечание: В системе ОЛЖ «ХартМейт» антикоагулянты не применяются.
4.2.6. Искусственное сердце.
Одной из последних разработок фирмы «Абиомед» в настоящее время является протез искусственного сердца «Абиокор» (Рисунок 5.26).
Испытания AbioCor на 14 пациентах показали, что это механическое сердце продлевает жизнь на месяцы. В двух случаях AbioCor "подарил" больным дополнительные 10 и 17 месяцев (и это — большой шаг вперёд по сравнению с прежними моделями подобных аппаратов), причем сбой искусственного сердца стал причиной смерти только в одном случае. Первый пациент, которому вживили AbioCor, был Роберт Тулз. Операция была выполнена 2 июля 2001 года, а в конце ноября он умер от инсульта.
Искусственное сердце «Абиокор» представляет собой электрогидравлическую полностью имплантируемую систему с производительностью более 8 л/мин.
Все контактирующие с кровью поверхности, включая четыре трехстворчатых клапана, как и в ранних конструкциях, изготовлены из полиуретана (Angioflex). Клапаны расположены тангенциально, что обеспечивает закрученный поток крови за ними.
Расположение основных узлов системы AbioCor показано на рисунке 5.27. Передача энергии производится чрезкожно при помощи трансформатора. Наличие внутренних литиевых батарей обеспечивает период полной автономии системы в течение 20 — 40 мин. Этого времени пациенту достаточно для того, чтобы, например, принять душ. Наружные батареи рассчитаны на 4 часа.

Рисунок 5.26. «AbioCor»
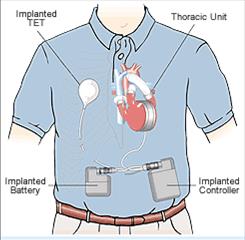
Рисунок 5.27. Расположение основных узлов системы AbioCor
В ортотопической позиции располагаются кровяные насосы тороидной формы, охватывающие с обеих сторон, расположенный между ними, конвертор энергии. Ударный выброс насосов 60 мл с фракцией выброса 85%. Поток крови в насосе линейной формы, полностью омывающей всю поверхность кровяной камеры. Объем насоса 70 см3 с наружным диаметром 101 мм /1/.
Конвертор энергии располагается между левым и правым ИЖС Центрифужный гидронасос и цилиндрический роторный клапан подают в пульсирующем режиме жидкость на диафрагму ИЖС, обеспечивая почти полное их опорожнение.
Физиологический баланс кровотока между большим и малым кругами кровообращения обеспечивается с помощью гидравлического шунта между правым и левым предсердиями, длиной 15 см. и диаметром 8 мм.
Центрифужный насос активируется бесщеточным электромотором с частотой оборотов 5000 — 7000 в мин.
Все внутренние элементы ИС имеют объем 868 мл. и массу менее 1 кг (907 гр.). Следует напомнить, что по данным Техасского института сердца и других кардиоцентров, объем сердца и полости перикарда у больных с ишемической кардиомиопатией составляет 955+186 мл, т.е. ИС «Абиокор» находится на грани допустимого предела имплантабельности. Возможно с этим связаны некоторые осложнения при клиническом применении «Абиокор».
В качестве рабочей жидкости искусственного сердца «Абиокор» служит силиконовое масло с плотностью 0,84 г/мл и вязкостью 1,5 центистокс.
Недавно имплантируемое искусственное сердце AbioCor получило одобрение от американского управления по контролю над пищевыми продуктами и медикаментами (FDA-Food and Drag Administration) (2006 г.). Теперь его имплантация должна принять более массовый характер. Потенциально речь идёт о сотнях, а, быть может, тысячах человек.
На рисунке 5.28 представлена блок-схема системы искусственного сердца.
Рассмотрим подробнее блоки, входящие в систему искусственного сердца.
Насос — гидравлическая машина, которая представляет собой устройство для перемещения жидкости в результате сообщения ей энергии.
Наиболее полно основным требованиям для систем искусственного кровообращения отвечают насосы из класса объемных: возвратно-поступательные мембранные насосы.
Система ИС включает в себя два искусственных желудочка, работающих в противофазе, с расположенным между ними приводом электромеханического типа, связанным кабелем с системой управления. Центральным компонентом привода системы полностью искусственного сердца является преобразователь вида движения (вращательного в возвратно-поступательное) – планетарная ролико-винтовая передача. Эта передача состоит из ходового винта с резьбой, гайки с внутренней резьбой и роликов с резьбой. К винту этой передачи с каждого конца прикреплен толкатель.
Планетарная ролико-винтовая передача расположена внутри полого ротора электродвигателя. Вентильный электродвигатель вращает гайку, перемещая при этом винт планетарной винтовой передачи. Ролики расположеные в пространстве между ходовым винтом и гайкой, сцепляются с тем и другим. Когда гайка вращается относительно ходового винта, ролики движутся по планетарной траектории вокруг ходового винта. Ролико-винтовые передачи применяются в случаях, когда требуется беспрецедентная надежность. Они характеризуются долгим сроком службы даже при постоянной работе, точностью позиционирования, высоким КПД, т.к. в отличие от обычной системы «винт-гайка» в ролико-винтовых передачах трение скольжения заменено трением качения.
Во время работы винтовая часть этой передачи удерживается от вращения, которое она получает от движения ротора электродвигателя, с помощью специальных направляющих стержней. Таким образом, толкатель может двигаться только прямолинейно.
В системе предусмотрены два портативных перезаряжаемых источника питания (резервный и основной). Основной источник питания расположен вне организма и закрепляется на поясе пациента. Время его работы без подзарядки – 8 час. Наличие внутренних резервных батарей обеспечивает период полной автономии системы в течение 30 минут.
Наиболее оптимальный вариант энергообеспечения имплантируемого искусственного сердца является применение неинвазивных источников с использованием чрезкожного трансформатора, используя принцип электромагнитной индукции.
Их основные преимущества:
- высокая эффективность;
- низкая опасность развития инфекции.
Система чрезкожной электромагнитной передачи энергии состоит из:
1. Двух катушек: подкожной (воспринимающей) и наружной (передающей), которые образуют своеобразный трансформатор;
2. Силового контура;
3. Контура выпрямителя.
Воспринимающая катушка имплантируется подкожно в верхней части брюшной стенки или в дельтопекторальной области и соединяется кабелем с имплантируемой системой привода и управления.
Передающая катушка располагается на коже непосредственно над имплантированной катушкой и соединяется кабелем с наружным контроллером.
Энергия для первичной (передающей) катушки может быть получена одним из трех источников:
- от наружной носимой батареи, передающей необходимую энергию через контроллер в систему чрезкожной передачи энергии;
- от любого другого наружного источника, например, от автомобильного аккумулятора и далее с передачей по предыдущей схеме на рабочие узлы устройства.
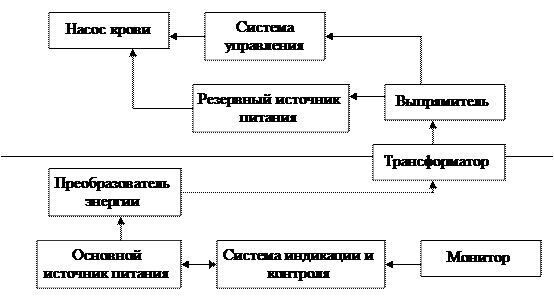
Рисунок 5.28. Блок-схема системы искусственного сердца
4.2.7. Структурная схема системы ВК.
Наиболее распространенным алгоритмом управления вспомогательным насосом крови является алгоритм, основанный на реализации закона Франка-Старлинга, формулируется для сердца как зависимость энергии сокращения насоса от венозного притока или давления наполнения.
Должен учитываться также такой важный фактор как внутрижелудочковая гемодинамика, обеспечивающая наиболее оптимальное течение крови в насосе с точки зрения минимизации малоразвитых течений. Перечисленным требованиям отвечает условие работы насоса в режиме полного заполнения и полного выброса (режим постоянного ударного объема) с переменной частотой сокращения.
Другим важным требованием является минимизация энергетических затрат на выброс крови, поскольку это определяет как тепловой режим насоса, так и время его автономной работы (без подзарядки батарей).
Искусственный насос крови, удовлетворяющий медицинским и техническим требованиям к подобного рода устройствам, представляет собой следующее:
В качестве насоса крови используется камера из медицинского полиуретана. Камера состоит из жесткого (толстостенного) корпуса с формой, подобной сферической, с двумя выведенными из него штуцерами. В каждом штуцере установлен клапан, допускающий течение крови только в одном направлении. В первом штуцере клапан обеспечивает возможность вытекания (выброса) крови из камеры, а во втором – втекание (наполнение) кровью камеры. С внутренней стороны камера ограничена эластичной (тонкостенной) мембраной, способной деформироваться и тем самым изменять внутренний объем камеры. При деформации мембраны в сторону жесткого корпуса, объем камеры сокращается, а при деформации в противоположную сторону– увеличивается.
Камера – искусственный желудочек сердца - закрепляется на корпусе двигателя в положении мембраной к приводу.
Привод представляет собой электромеханическую систему. Выходным элементом привода является толкатель с наружной поверхностью, подобной выпуклой сферической, обращенной к искусственному желудочку. Толкатель может совершать возвратно-поступательные движения. При движении к мембране, толкатель, деформируя ее, сокращает объем искусственного желудочка и, тем самым, производит опорожнение его – выброс крови из желудочка через выходной клапан (фаза изгнания). При движении в обратном направлении толкатель отходит от мембраны, позволяя ей деформироваться в сторону увеличения объема искусственного желудочка т.е. происходит наполнение желудочка кровью через входной клапан под действием венозного давления (фаза притока).
Перемещение толкателя осуществляется вентильным двигателем с датчиками положения ротора и встроенным в ротор преобразователем вращательного движения ротора в поступательное движение винтового штока с закрепленным на нем толкателем. Толкатель может совершать лишь поступательное движение по направляющим в корпусе двигателя без возможности поворота. При изменении направления вращения ротора двигателя происходит смена направления поступательного движения толкателя. Ход толкателя ограничен механическими упорами в корпусе привода.
Контроль степени наполнения желудочка кровью в фазе притока осуществляется датчиком положения мембраны.
Основой алгоритма работы привода ИЖС заключается в следующем.
Исходной информацией о работе искусственного насоса крови являются сигналы с датчиков положения ротора (ДПР) двигателя, позволяющие отслеживать перемещение толкателя и датчика положения мембраны искусственного желудочка.
При вращении ротора двигателя с датчиков положения ротора поступают импульсы, количество которых жестко связано с углом поворота ротора соотношением
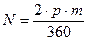 ;
;
где N – количество импульсов на один градус угла поворота ротора, p – число пар полюсов ротора, m – число фаз двигателя (количество датчиков положения ротора).
Начальное положение ротора двигателя определяется механическим упором толкателя в крайнем "нижнем" положении, соответствующем максимальному наполнения искусственного желудочка.
Начало вращения ротора двигателя, совпадающее с началом движения толкателя «вверх» (начало фазы изгнания), сопровождается подсчетом количества импульсов с ДПР. Толкатель за время движения вверх проходит строго определенный путь, задаваемый количеством импульсов от ДПР. При движении толкателя "вверх" он перемещает мембрану желудочка, опорожняя его. При достижении толкателем крайнего "верхнего" положения, соответствующего максимальному опорожнению искусственного желудочка, вращение двигателя меняется на противоположное. Толкатель начинает движение «вниз». При движении толкателя "вниз" он отходит от мембраны, освобождая ее и позволяя желудочку наполняться пассивно за счет венозного давления крови. По мере хода "толкателя" вниз производиться обратный отсчет числа импульсов с ДПР до момента, когда их количество не станет равным нулю. В этот момент толкатель останавливается в крайнем "нижнем положении". Мембрана продолжает движение в сторону заполнения.
При скорости отвода толкателя большей скорости движения мембраны он не препятствует наполнению желудочка. Для соблюдения такой разности скоростей движения толкателя и мембраны производится измерение скорости перемещения толкателя и скорости перемещения мембраны.
Скорость движения толкателя при ходе "вниз" контролируется по датчикам положения ротора (ДПР). Скорость движения мембраны определяется по датчику положения мембраны.
Датчик положения мембраны измеряет положение мембраны относительно жесткого корпуса. В качестве датчика положения мембраны может служить, например, датчик на эффекте Холла, установленный на жестком корпусе искусственного желудочка или на приводе, под толкателем. Напротив датчика Холла на мембране устанавливается постоянный магнит. Сигнал, снимаемый с датчика Холла пропорционален расстоянию от него до магнита и, следовательно, расстоянию от мембраны до внешнего жесткого кожуха искусственного желудочка. Это измеренное расстояние пропорционально объему крови, поступившей в желудочек при его заполнении. Контролируя скорость изменения (увеличения) объема поступающей крови, определяем момент времени, при котором эта скорость становится равной нулю. Этот факт фиксируется и является моментом окончания процесса наполнения желудочка (окончанием фазы притока).
Таким образом, измеряя интервал времени от момента начала движения толкателя "вниз" (момент начала фазы притока) до момента окончания наполнения (момент окончания фазы притока) определяем длительность фазы притока.
В момент окончания фазы притока, толкатель, предварительно отведенный в крайнее нижнее положение и находящийся там в ожидании этого момента, начинает движение "вверх" (начало фазы изгнания). Длительность фазы изгнания пропорциональна длительности фазы притока.
После окончания фазы изгнания и достижением толкателем вместе с перемещаемой им мембраной крайнего "верхнего" положения, толкатель начинает двигаться "вниз". Время за которое толкатель придет в свое крайнее "нижнее" положение задается меньшим, чем время фазы притока, измеренное на предыдущем этапе.
Далее последовательность действий циклически повторяется в автоматическом режиме.
При скачкообразном изменении длительности фазы притока крови, вызванном какими-либо медицинскими или техническими причинами, изменение соответствующей длительности фазы изгнания происходит не скачком, а поэтапным ее изменением с шагом, соответствующим, например, 10% от требуемого изменения времени изгнания.
Приведенный алгоритм функционирования имплантируемой системы вспомогательного кровообращения позволяет реализовать известный закон Франка-Старлинга, сформулированный для подобных систем, а именно:
полное опорожнение искусственного желудочка сердца на каждом цикле;
зависимость скорости выброса крови, частоты сердечных сокращений и, следовательно энергии выброса, от скорости притока крови.
Измерение скорости движения мембраны и фиксация момента достижения этой скорости нулевого значения имеет преимущество по сравнению с фиксацией крайнего нижнего положения мембраны, посредством сравнения сигнала с датчика положения мембраны с пороговым значением, соответствующим крайнему "нижнему" положению мембраны и полному наполнению искусственного желудочка. При фиксации положения мембраны существенным оказывается погрешность измерения, связанная с влиянием изменения параметров канала измерения, например по причине "ухода" параметров магнита или параметров других элементов канала от времени, температуры и т.п. Измерение скорости и фиксация ее нулевого значения нивелирует эти влияния, сохраняя неизменным принцип функционирования системы на протяжении длительного времени и при изменении иных условий. Блок-схема системы управления приведена на рисунке 5.29.
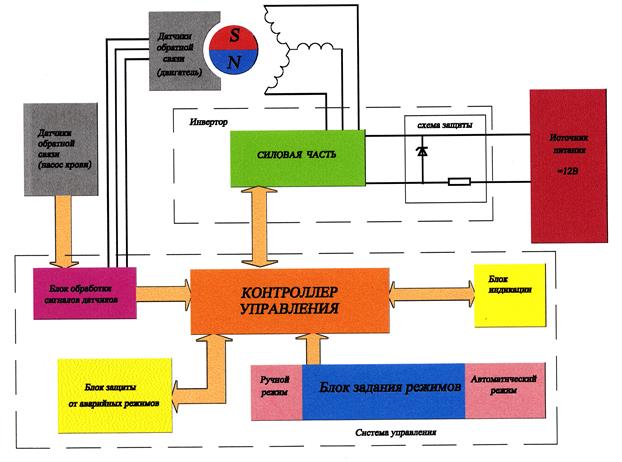
Рисунок 5.29. - Блок-схема системы управления.
4.2.9. Алгоритм функционирования блока управления системы ВК:
1. Инициализация.
Взаимодействие контроллеров при инициализации показано на рисунке 5.30. В момент времени t0 происходит включение источника питания. В интервале t0…t1
продолжительностью 72 мс контроллер ДПМ удерживается внутренней схемой в состоянии сброса. Выводы контроллера настроены на вход (находятся в третьем состоянии с высоким импедансом) и потенциалы на них не определены (если не заданы внешней схемой). В течении этого времени напряжение питания должно увеличиться до установившегося значения 5В±10%.
В момент t1 контроллер ДПМ выходит из состояния сброса и в интервале t1…t2 продолжительностью 50мс выполняет внутреннюю настройку и первичное накопление результатов измерений положения мембраны для вычисления среднего значения. В момент t2 вычисляется первое среднее значение положения мембраны по n точкам и контроллер ДПМ устанавливает 1 на выходе «ОТВЕТ», свидетельствующую о переходе контроллера в состояние готовности к работе.

 После завершения внутренних настроек ведущий контроллер возвращает толкатель в исходное положение и изменяет уровень на выходе «ЗАПРОС» из 1 в 0 (момент t3). Это изменение уровня для контролера ДПМ является командой «НАЧАЛО КОНТРОЛЯ», по которой он начинает проверку наполнения желудочка. После этого ведущий контроллер переходит к проверке получения команды «НАЧАЛО КОНТРОЛЯ».
После завершения внутренних настроек ведущий контроллер возвращает толкатель в исходное положение и изменяет уровень на выходе «ЗАПРОС» из 1 в 0 (момент t3). Это изменение уровня для контролера ДПМ является командой «НАЧАЛО КОНТРОЛЯ», по которой он начинает проверку наполнения желудочка. После этого ведущий контроллер переходит к проверке получения команды «НАЧАЛО КОНТРОЛЯ».
2. Проверка получения команды «НАЧАЛО КОНТРОЛЯ».
В течение времени задержки подтверждения tзп (30мкс максимально) после получения команды «НАЧАЛО КОНТРОЛЯ» (момент t3), контроллер ДПМ должен подтвердить её приём сбросив выход «ОТВЕТ» в 0 (момент t4). Спустя время задержки контроля tзк (500мкс), ведущий контроллер проверяет подтверждение в виде 0 (момент t5).
Если, подтверждение не получено, то выдаётся сообщение о потере связи с контроллером ДПМ и система переводится в полуавтоматический режим, совмещённый с проверкой наполнения желудочка и связи между контроллерами (п. 5). На рисунке 5.31 показан переход в полуавтоматический режим при отсутствии подтверждения команды «НАЧАЛО КОНЕТРОЛЯ» и выход из него при получении подтверждения (полуавтоматический режим обозначен пунктирной линией).
Если подтверждение получено, то ведущий контроллер переходит к проверке состояния выхода «ОБРЫВ ДАТЧИКА».
3. Проверка состояния выхода «ОБРЫВ ДАТЧИКА».
При обрыве линий связи между контроллером ДПМ и датчиком Холла сигнал на входе контроллера будет либо больше уровня CLMPH, либо меньше уровня CLMPL. В этом случае контроллер ДПМ установит 1 на выходе «ОБРЫВ ДАТЧИКА».
При обнаружении 1 на выходе «ОБРЫВ ДАТЧИКА», выдаётся сообщение об обрыве датчика, и система переводится в полуавтоматический режим, совмещённый с проверкой наполнения желудочка и связи между контроллерами (п. 5). На рисунке 5.32 показан переход в полуавтоматический режим при обнаружении 1 на выходе «ОБРЫВ ДАТЧИКА» и выход из него при восстановлении 0 (полуавтоматический режим обозначен пунктирной линией).
При обнаружении на нём 0 система переводится в автоматический режим (режим ожидания изменения уровня на выходе «ОТВЕТ» из 0 в 1, являющегося командой ДПМ «НАПОЛНЕНИЕ ОКОНЧЕНО»).
4. Автоматический режим (ожидание команды «НАПОЛНЕНИЕ ОКОНЧЕНО»). Взаимодействие контроллеров в автоматическом режиме показано на рисунке 5.33.
В момент t6 наполнение желудочка заканчивается. Контроллер ДПМ фиксирует окончание наполнения и спустя время определения положения tоп (20мс) (момент t7) изменяет уровень на выходе «ОТВЕТ» из 0 в 1 (команда «НАПОЛНЕНИЕ ЗАКОНЧЕНО»). По этой команде ведущий контроллер устанавливает 1 на выходе «ЗАПРОС» (момент t8), выполняет цикл систола-диастола и, при возврате толкателя в исходное положение (момент t9), сбрасывает выход «ЗАПРОС» в 0. Состояние системы в момент t9 аналогично состоянию в момент t3. Дальнейшее взаимодействие продолжается согласно алгоритму проверки получения команды «НАЧАЛО КОНТРОЛЯ» (п. 2) аналогично интервалу t3…t5 с последующей проверкой состояния выхода «ОБРЫВ ДАТЧИКА» (п. 3). Если результат обеих проверок положительный, то система вновь переходит к ожиданию команды «НАПОЛНЕНИЕ ЗАКОНЧЕНО». Если результат хотя бы одной из проверок отрицательный, то система переводится в полуавтоматический режим, совмещённый с проверкой наполнения желудочка и связи между контроллерами (п. 5).


 Напряжение
Напряжение
 питания
питания

Перемещение

 толкателя
толкателя
 |  |  | |||||||
 | |||||||||
 |
Перемещение
мембраны
 CLMPH
CLMPH

Uпорог
 |
 CLMPL
CLMPL
Сигнал
«Запрос»






 ведущего
ведущего
контроллера
 |







 Сигнал tзк tзк
Сигнал tзк tзк
«Ответ»
от tзп tоп tзп tоп







 контроллера
контроллера







 АЦП
АЦП
 |
Сигнал
«Обрыв
датчика»
 | ||
 |
t0 t1 t2 t3
 |  |
Инициализирующие какое-либо воздействие сигналы (команды) обозначены стрелкой. Ответные реакции на них обозначены стрелкой.
Рисунок 5.30.


 Напряжение
Напряжение
 питания
питания

Перемещение
толкателя
 |  |  | 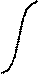 | ||||||||
 | |||||||||||
 |
 Перемещение
Перемещение
мембраны
 CLMPH
CLMPH
 |  |  | |||
 Uпорог
Uпорог
 |  |
 CLMPL
CLMPL

Сигнал 30мс 30мс



 «Запрос»
«Запрос»







 ведущего
ведущего
контроллера
 |



 Сигнал tзк tзк
Сигнал tзк tзк
«Ответ»
от tзп tзп tоп tоп









 контроллера
контроллера








 АЦП
АЦП
 |
Сигнал
«Обрыв
датчика»
 | ||
 |
t0 t1 t2 t3 t4 t5 t6 t7
 |  |
Инициализирующие какое-либо воздействие сигналы (команды) обозначены стрелкой. Ответные реакции на них обозначены стрелкой.
Рисунок 5.31.


 Напряжение
Напряжение
 питания
питания

Перемещение
толкателя
 |  |  |  | ||||||||
 | |||||||||||
 |
 Перемещение
Перемещение
мембраны
 CLMPH
CLMPH
 |  |  | |||||
 | |||||||
 Uпорог
Uпорог
 |  |
 CLMPL
CLMPL

Сигнал 30мс 30мс



 «Запрос»
«Запрос»







 ведущего
ведущего
контроллера
 |



 Сигнал tзк tзк
Сигнал tзк tзк
«Ответ»
от tзп tзп tоп tоп









 контроллера
контроллера







 АЦП
АЦП
 |
Сигнал
«Обрыв
датчика»
 | ||||
 | ||||
 |
t0 t1 t2 t3 t4 t5 t6 t7
 |  |
Инициализирующие какое-либо воздействие сигналы (команды) обозначены стрелкой. Ответные реакции на них обозначены стрелкой.
Рисунок 5.32.


 Напряжение
Напряжение
 питания
питания

Перемещение
толкателя
 |  |  | |||||||
 | |||||||||
 |
Перемещение
мембраны
 CLMPH
CLMPH

Uпорог
 |
 CLMPL
CLMPL
Сигнал
«Запрос»






 ведущего
ведущего
контроллера
 |







 Сигнал tзк tзк
Сигнал tзк tзк
«Ответ»
от tзп tоп tзп tоп







|
|
 2015-04-30
2015-04-30 1315
1315







