Окисление – это процесс превращения органических веществ под влиянием тех или иных окисляющих агентов. Отличие от окислительного дегидрирования состоит в том, что реакция не сопровождается выделением свободного водорода, т.к. он связывается в воду.
Практическое значение процесса окисления в промышленности основного органического синтеза трудно переоценить. Их первостепенную роль обусловили следующие причины:
- большая ценность соединений, получаемых окислением (спиртов, альдегидов и т.д.) и являющихся промежуточными продуктами органического синтеза, растворителями и исходными веществами для производства полимерных материалов, пластификаторов и т.д.;
- доступность и низкая стоимость большинства окислителей, среди которых главное место занимает кислород воздуха. Это определяет более высокую экономичность синтеза некоторых продуктов методами окисления по сравнению с другими возможными методами их производства. В последние годы наметилась явная тенденция к замене прежних путей синтеза многих веществ окислительными методами, например синтез ацетальдегида без участия ацетилена, в данном дипломном проекте рассмотрен процесс получение ацетальдегида прямым окислением этилена кислородом воздуха.
С этой точки зрения окисление следует считать одним из самых перспективных процессов органического синтеза, играющий всё более важную роль в научных исследованиях и промышленности.
В окислительных превращениях следует различать полное и неполное окисление.
Полное окисление – это процесс сгорания органических веществ с образованием двуокиси углерода, воды и т.д. Он имеет важное значение как источник тепловой энергии для промышленности, транспорта, в быту, для биологической очистки сточных вод. Однако, при синтезе каких – либо органических соединений полное окисление исходного вещества является нежелательным побочным процессом, ведущим к снижению выхода целевого продукта и чрезмерному выделению тепла. Для органического синтеза имеет значение только неполное (частичное) окисления.
Реакции неполного окисления можно разделить на три основные группы:
- окисление без разрыва углеводородной цепи;
- деструктивное окисление, протекающее с расщеплением углерод – углеродной связи;
- окисление, сопровождающееся связыванием молекул исходных реагентов (окислительная конденсация).
Окисление олефинов по ненасыщенному атому углерода с образованием карбонильных соединений, не сопровождающееся деструкцией углеродной цепи, представляет не только теоретический, но и большой практический интерес. На основе низших олефинов С2 – С4 этим методом в настоящее время в промышленности получают такие ценные соединения, как ацетальдегид, винилацетат, ацетон, метилэтилкетон.
В лабораторных синтезах применяют окислительные агенты, такие как перманганаты, бихроматы и т.д., а в промышленности основного органического синтеза пользуются более дешёвыми окислителями.
В промышленном процессе синтеза ацетальдегида на ОАО «Омский каучук» в качестве окислительного агента применяется молекулярный кислород (воздух), он является важным агентом, т.к. концентрированный кислород оказывает более сильное окисляющее действие, но его применение связано с дополнительными затратами на разделение воздуха. Меньшую скорость реакции при окислении воздухом компенсируют высокой температурой или увеличением общего давления, ведущим к росту парциального давления кислорода. Отделение синтеза ацетальдегида служит для окисления этилена в уксусный альдегид катализаторным раствором, последующего окисления катализаторного раствора кислородом воздуха и активации катализаторного раствора.
Процесс прямого окисления этилена в ацетальдегид может осуществляться как с использованием жидкого каталитического раствора (гомогенно-каталитический процесс), так и на твердом катализаторе (гетерогенно-каталитический процесс).
Гомогенные процессы обладают следующими преимуществами: гомогенный катализатор полностью растворим, и теоретически каждый атом металла может участвовать в реакции, в отличие от гетерогенного окисления, в котором активны только поверхностные атомы. Гомогенные катализатора являются высокоселективными. При гомогенном процессе окисления, как правило, конструкция реактора более проста; отвод тепла производится часто проще, чем в случае гетерогенного процесса, за счет испарения продуктов синтеза или исходных реагентов.
Образование ацетальдегида при взаимодействии этилена с водным раствором хлорида палладия (РdCl2) впервые было описано ещё в 1984 году Шмидтом и является одним из новейших процессов в промышленности органического синтеза и весьма перспективным.
Окисление олефинов по ненасыщенному атому углерода с образованием карбонильных соединений, не сопровождающееся деструкцией углеродной цепи, происходит под влиянием хлористого палладия:
РdCl2
CH2=CH2+ 0,5О2 → CH3-COH+ 58 ккал/г моль (1)
Если в реакционную массу вместе с олефином вводить кислород (или воздух), происходит окисление палладия, но реакция протекает слишком медленно. Заслуга Шмидта состоит главным образом в создании окислительно-восстановительной системы, в которой палладий быстро окисляется, т.е. непрерывно регенерируется в активной форме. Оказалось, что, если добавить в реактор соль двухвалентной меди, она окисляет палладий, переходя в одновалентную медь, легко окисляемую кислородом. Иными словами, соли меди служат переносчиками кислорода: Рd + 2СuС1+ → РdС1+ + 2Сu+ (2)
2Сu+ + 0,5О2 +2HC1 → 2СuС1+ + Н2О (3)
Обе реакции эффективно протекают в кислой среде, в которой хлористый палладий находится в форме Н2РdCl4.
Механизм процесса включает промежуточные стадии замещения хлорид-анионов в координационной сфере палладиевого комплекса молекулами олефина и воды (этим вызвано замедляющее влияние больших концентраций хлорид-анионов). Координационный комплекс хлористого палладия с олефином и водой обратимо отщепляет протон, чем объясняется торможение реакции при значительных концентрациях ионов водорода. Дальнейшая реакция протекает внутри образовавшегося нового комплекса, причём гидроксильный ион атакует один из ненасыщенных углеродных атомов олефинов с одновременной миграцией гидрид- иона к соседнему атому углерода и выделением металлического палладия. Всё вышеизложенное для случая окисления этилена в ацетальдегид можно представить следующей схемой:
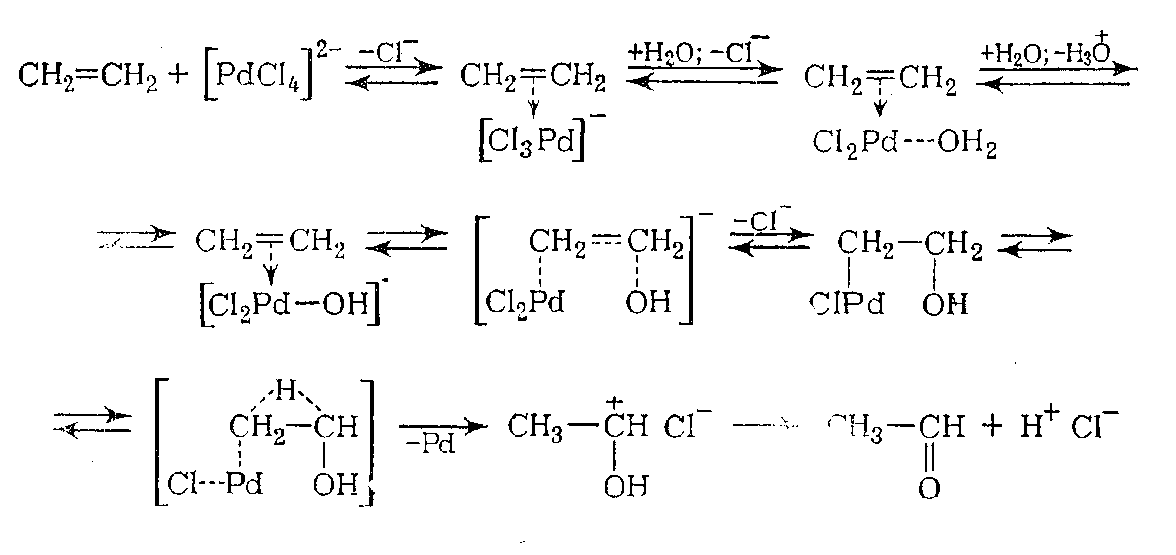 |
Реакция окисления идёт с выделением тепла, т.е. реакция экзотермическая.
Кроме основных реакций, приводящих к образованию целевого продукта (ацетальдегида), в процессе синтеза протекают побочные превращения:
- уксусная кислота является продуктом дальнейшего окисления ацетальдегида:
СН3 – СОН + 0,5О2 → СН3 – СООН (4)
- кротоновая конденсация двух молекул ацетальдегида даёт кротоновый альдегид:
СН3 – СОН + СН3 – СОН → СН3 – СН = СН – СОН+ Н2О (5)
- хлористый этил образуется в результате гидрохлорирования этилена:
СН2 = СН2 + НCl → СН3 – СН2Cl (6)
- в результате хлорирования ацетальдегида сильным хлорирующим агентом хлорной медью – образуются хлорпроизводные ацетальдегида:
СН3 – СОН + 2СuCl2 → СН2Cl – СОН + 2СuCl + НCl (7)
монохлорацетальдегид
- хлорзамещённые ацетальдегиды окисляются до моно-, ди- и трихлоруксусных кислот, которые могут распадаться с образованием углекислоты и соответствующих хлорпроизводных метана:
СН2 Cl – СОН + 0,5 О2 → СН2Cl – СОOН → СН3Cl (8)
-CO2
монохлоруксусная хлористый
кислота метил
Скорость отдельных реакций и, соответственно, скорость образования побочных продуктов зависит от условий протекания процесса. На скорость суммарной реакции, селективность процесса и выход ацетальдегида существенно влияет состав катализаторного раствора (содержание PdCl2 и CuCl2), и кислотность среды, давление, температура, соотношение этилена и окисляющего агента.
 2015-04-20
2015-04-20 1369
1369
