В 17 – 19 веках экспериментально были установлены ряд зависимостей, которые стали называться законами идеальных газов.
1.При постоянной температуре удельные объёмы данного газа обратно пропорциональны его абсолютным давлениям: (Бойля-Мариотта)
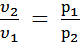 (1.1) (при Т= const), где индексы 1 и 2 относятся соответственно к начальному и конечному состоянию газа в процессе его расширения или сжатия. Из выражения (1) следует, что pυ = const. (1.2)
(1.1) (при Т= const), где индексы 1 и 2 относятся соответственно к начальному и конечному состоянию газа в процессе его расширения или сжатия. Из выражения (1) следует, что pυ = const. (1.2)
2.При постоянном абсолютном давлении удельные объёмы идеального газа прямо пропорциональны его абсолютным температурам: (Гей-Люссака)
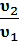 =
= 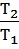 (при р = const) (1.3) Из уравнения (1.3) следует, что
(при р = const) (1.3) Из уравнения (1.3) следует, что 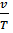 = const (1.4)
= const (1.4)
3. При постоянном объёме данной массы газа абсолютные давления идеального газа прямо пропорциональны его абсолютным температурам:
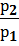
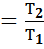 (при v= const) (1.5). Это выражение можно записать в следующем виде:
(при v= const) (1.5). Это выражение можно записать в следующем виде: 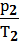
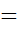
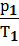 , или
, или 
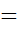 const. (Шарля)
const. (Шарля)
Основные термодинамические параметры состояния P,V,T газа зависят один от другого и взаимно связаны уравнением состояния идеального газа:
pυ = RT,
где: p – давление; υ –удельный объём; Т – температура; R - газовая постоянная (у каждого газа своё значение).
 2015-05-05
2015-05-05 1058
1058








