| Элемент | Объем продуктов горения (м3) на 1 кг вещества | ||||
| СО2 | Н2О | SO2 | Р2О5 | N2 | |
| Углерод | 1,87 | 7,0 | |||
| Водород | 11,2 | 21,0 | |||
| Сера | 0,7 | 2,63 | |||
| Фосфор | 0,36 | 3,4 | |||
| Азот в горючем | 0,8 | ||||
| Азот за счет кислорода в горючем | - 2,63 | ||||
| Влага в горючем | 1,24 |
Используя данные таблицы 1., можно вычислить объем продуктов горения любого вещества с известным элементным составом.
Пусть w (С), w (Н), w (S), w (О),w (N) – – массовые доли элементов в веществе, %; w (W) – содержание влаги в веществе, %.
Тогда общие формулы для расчета каждого компонента продуктов горения при сгорании заданной массы (m) вещества будут иметь следующий вид:
V(СО2) = m× 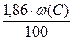 , м3 (9)
, м3 (9)
V(H2O) = m× 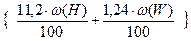 , м3 (10)
, м3 (10)
V(SО2) = m× 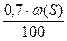 , м3 (11)
, м3 (11)
V(N2) = m× 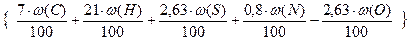 , м3 (12)
, м3 (12)
| Расчет объема и процентного состава продуктов горения вещества сложного элементного состава | Пример 7. Определить объем и процентный состав продуктов горения 5 кг каменного угля следующего состава (в %): С – 75,8 %, Н – 3,8 %, О – 2,8 %, S – 2,5 %, N – 1,1 %, W – 3,0 %, зола – 11,0 %. Горение протекает при a = 1,3, условия нормальные. |
1. По формулам (9) – (12) определяем объем каждого компонента продуктов горения 5 кг каменного угля.
V(СО2) = 5 × 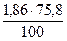 = 7 м3
= 7 м3
V(H2O) = 5 × 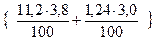 = 2,31 м3
= 2,31 м3
V(SО2) =5 × 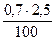 = 0,085 м3
= 0,085 м3
V(N2) = 5 × 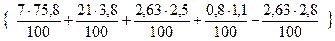 = 33,14 м3
= 33,14 м3
VПГ = 7 + 2,31 + 0,085 + 33,14 = 42,5 м3
2. Горение протекает с коэффициентом избытка воздуха 1,3, следовательно, в состав продуктов горения будет входить избыточный воздух.
По формуле (3.8) определяем теоретический объем воздуха, необходимый для горения данной массы образца угля:
Vвтеор = 5 × 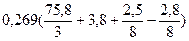 = 38,6 м3
= 38,6 м3
Избыток воздуха определим по формуле (4):
DVв= Vвтеор(a -1) = 38,6×(1,3 – 1) = 11,6 м3
С учетом избытка воздуха практический объем продуктов горения составит:
VПГ* = VПГ + DVв = 42,5 + 11,6 = 54,1 м3
2. Определим процентный состав продуктов горения:
jоб (СО2) = 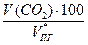 =
= 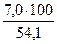 = 12,9 %
= 12,9 %
jоб (Н2О) = 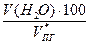 =
= 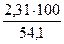 = 4,3 %
= 4,3 %
jоб (SО2) = 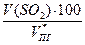 =
= 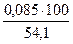 = 0,2 %
= 0,2 %
jоб (N2) = 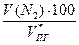 =
= 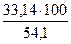 = 61,2 %
= 61,2 %
jоб (DVв) = 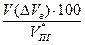 =
= 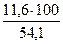 = 21,4 %
= 21,4 %
После рассмотрения методики решения задач на материальный баланс обучающиеся выполняют индивидуальную работу под контролем преподавателя по заранее выданным заданиям.
 2015-05-05
2015-05-05 906
906








