71. Задание {{ 92 }} ТЗ 70 Тема 1-5-0
Идеальным газом называют воображаемый газ, молекулы которого:
R представляют собой упругие материальные точки, не связанные друг с другом межмолекулярными силами сцепления
£ имеют пренебрежимо малые размеры и находятся в неподвижном состоянии
£ имеют размеры, сопоставимые с их свободным пробегом и между которыми действуют кулоновские силы отталкивания
£ имеют пренебрежимо малые размеры и между которыми действуют только гравитационные силы
£ имеют пренебрежимо малые размеры и между которыми действуют только ядерные силы
72. Задание {{ 93 }} ТЗ 71 Тема 1-5-0
Установить соответствие между названием процесса и его характеристикой:
| Изотермический | Процесс изменения давления газа в зависимости от объема, протекающий при неизменной температуре |
| Изобарический | Процесс изменения объема газа в зависимости от температуры, протекающий при неизменном давлении |
| Изохорический | Процесс изменения давления газа в зависимости от температуры, протекающий при неизменном объеме |
| Адиабатический | Процесс, протекающий при отсутствии теплообмена между системой и окружающей средой |
| Политропический | Обратимый термодинамический процесс изменения состояния идеального газа, удовлетворяющий уравнению 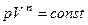
|
| Тепловой процесс (теплопередача) | Процесс изменения внутренней энергии, обусловленный ее передачей в результате теплового движения молекул без совершения работы внешними силами |
73. Задание {{ 94 }} ТЗ 72 Тема 1-5-0
Установить соответствие между названием процесса и его уравнением:
| Изотермический | 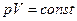
|
| Изобарический | 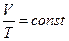
|
| Изохорический | 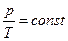
|
| Адиабатический | 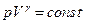
|
74. Задание {{ 95 }} ТЗ 73 Тема 1-5-0
Установить соответствие между уравнением экспериментального газового закона и его названием:
| Менделеева-Клапейрона | 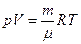
|
| Гей-Люссака | 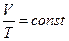
|
| Бойля-Мариотта | 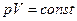
|
| Шарля | 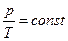
|
| Пуассона | 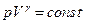
|
75. Задание {{ 96 }} ТЗ 74 Тема 1-5-0
Установить соответствие между физическими величинами, характеризующими состояние идеального газа, и их размерностью:
| Давление | 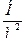
|
| Универсальная газовая постоянная | 
|
| Температура | 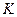
|
| Объем | 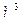
|
76. Задание {{ 97 }} ТЗ 75 Тема 1-5-0
Установить соответствие между элементами:
| Величина давления газа | Прямо пропорционально средней кинетической энергии поступательного движения молекул, содержащихся в единице объема газа. |
| Средняя кинетическая энергия поступательного движения молекулы идеального газа | Пропорциональна абсолютной температуре и зависит только от нее |
| Внутренняя энергия любой массы газа | Пропорциональна числу степеней свободы молекулы, абсолютной температуре и массе газа |
| Универсальная газовая постоянная | Численно равна работе по расширению моля идеального газа при нагревании его на 1 К |
| Средняя квадратичная скорость молекул | Пропорциональна корню квадратному из абсолютной температуры и зависит только от нее |
77. Задание {{ 169 }} ТЗ 140 Тема 1-5-0
Внутренняя энергия идеального газа зависит только от его:
£ объема и не зависит от температуры
£ давления и не зависит от температуры
R температуры и не зависит от объема
£ объема и не зависит от давления
£ давления и не зависит от объема
78. Задание {{ 170 }} ТЗ 141 Тема 1-5-0
Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема. Это утверждение известно в термодинамике как закон:
£ Кулона
£ Джоуля
R Больцмана
£ Клаузиуса
£ Карно
79. Задание {{ 171 }} ТЗ 142 Тема 1-5-0
Внутренняя энергия одного моля идеального одноатомного газа (гелий, неон и др.), молекулы которого совершают только поступательное движение, равна:
£ 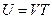
R 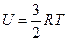
£ 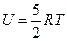
£ 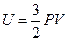
£ 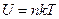
80. Задание {{ 172 }} ТЗ 137 Тема 1-5-0
В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа газа выражается формулой:
R 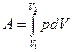
£ 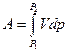
£ 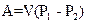
£ 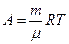
£ 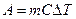
81. Задание {{ 173 }} ТЗ 228 Тема 1-5-0
Работа газа численно равна площади под графиком процесса на диаграмме:
£ (V,T)
£ (A,T)
R (p, V)
£ (p,T)
£ (R,T)
82. Задание {{ 174 }} ТЗ 139 Тема 1-5-0
В соответствии с первым законом термодинамики количество теплоты, полученное системой:
£ Идет на изменение ее давления и не зависит от изменения температуры
R Идет на изменение ее внутренней энергии и совершение работы: 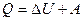
£ Зависит только от изменения ее объема и не зависит от изменения температуры
£ Идет на совершение работы и не зависит от изменения ее внутренней энергии
£ Идет на изменение ее внутренней энергии и не зависит от совершения работы
83. Задание {{ 175 }} ТЗ 140 Тема 1-5-0
В изохорном процессе:
£ Количество теплоты, подводимое к системе, полностью затрачивается на совершение работы
£ Первый закон термодинамики записывается в виде Q = U(T2) – U(T1) + p(V2 – V1) = ΔU + pΔV
£ Температура газа не изменяется, т.е. не изменяется и его внутренняя энергия: ΔU = 0
R Газ работы не совершает, следовательно, Q = ΔU = U(T2) – U(T1)
£ Работа, совершаемая газом, выражается соотношением A = p(V2 – V1) = pΔV
84. Задание {{ 176 }} ТЗ 141 Тема 1-5-0
В изобарном процессе:
£ Температура газа не изменяется, т.е. не изменяется и его внутренняя энергия: ΔU = 0
£ Первый закон термодинамики записывается в виде Q = ΔU
£ Количество теплоты, подводимое к системе, полностью затрачивается на совершение работы
£ Газ работы не совершает, следовательно, Q = ΔU = U(T2) – U(T1)
R Работа, совершаемая газом, выражается соотношением A = p(V2 – V1) = pΔV
85. Задание {{ 177 }} ТЗ 142 Тема 1-5-0
В изотермическом процессе:
£ Газ работы не совершает, следовательно, Q = ΔU = U(T2) – U(T1)
£ Q = 0, поэтому первый закон термодинамики принимает вид A = –ΔU, т. е. газ совершает работу за счет убыли его внутренней энергии
£ Первый закон термодинамики записывается в виде Q = ΔU
R Температура газа не изменяется, также не изменяется и внутренняя энергия газа, т.е. ΔU = 0
£ Количество теплоты, подводимое к системе, полностью затрачивается на совершение работы
86. Задание {{ 178 }} ТЗ 143 Тема 1-5-0
В адиабатическом процессе:
£ Температура газа не изменяется, также не изменяется и внутренняя энергия газа, т.е. ΔU = 0
£ Газ работы не совершает, следовательно, Q = ΔU = U(T2) – U(T1)
£ Первый закон термодинамики записывается в виде Q = ΔU
£ Количество теплоты, подводимое к системе, полностью затрачивается на совершениеработы
R Q = 0; поэтому первый закон термодинамики принимает вид A = –ΔU, т. е. газ совершает работу
за счет убыли его внутренней энергии
87. Задание {{ 179 }} ТЗ 144 Тема 1-5-0
Уравнение адиабатического процесса в координатах (p, V) имеет вид:
£ 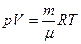
£ 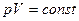
R pVγ = const
£ 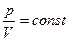
£ 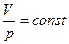
88. Задание {{ 180 }} ТЗ 229 Тема 1-5-0
В термодинамике соотношение 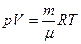 известно как уравнение:
известно как уравнение:
£ Пуассона
£ Больцмана
£ Клаузиуса
£ Карно
R Менделеева-Клайперона
89. Задание {{ 181 }} ТЗ 145 Тема 1-5-0
Работа газа в адиабатическом процессе определяется выражением:
£ 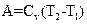
R 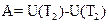
£ 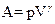
£ 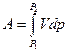
£ 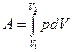
90. Задание {{ 182 }} ТЗ 146 Тема 1-5-0
Изменение энтропии в каком-либо квазистатическом процессе равно:
£ 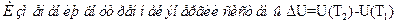
£ 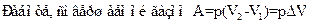
R Приведенному теплу 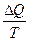 , полученному системой
, полученному системой
£ Работе, совершаемой над системой 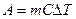
£ 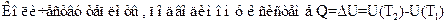
91. Задание {{ 183 }} ТЗ 147 Тема 1-5-0
Соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид:
£ 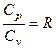
£ 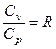
£ 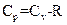
R 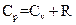
£ 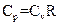
92. Задание {{ 184 }} ТЗ 148 Тема 1-5-0
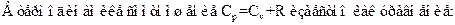
£ Джоуля
£ Больцмана
£ Клаузиуса
R Майера
£ Карно
93. Задание {{ 185 }} ТЗ 148 Тема 1-5-0
Энтропия S системы и термодинамическая вероятность W связаны между собой соотношением:
R 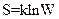
£ 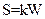
£ 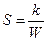
£ 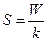
£ 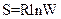
94. Задание {{ 186 }} ТЗ 149 Тема 1-5-0
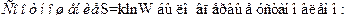
£ Джоулем
£ Клаузиусом
£ Майером
R Больцманом
£ Карно
95. Задание {{ 187 }} ТЗ 150 Тема 1-5-0
В соответствии со вторым законом термодинамики:
£ Для всех термодинамических процессов справедливо соотношение: 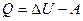
£ Все термодинамические процессы являются обратимыми
£ Все термодинамические процессы являются необратимыми
R Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой
£ Количество теплоты, полученное системой при обратимом процессе, идет на совершение работы и не зависит от изменения ее внутренней энергии
96. Задание {{ 188 }} ТЗ 151 Тема 1-5-0
Формулировка 2-го закона термодинамики была впервые дана:
£ Джоулем
R Клаузиусом
£ Больцманом
£ Карно
 2015-04-20
2015-04-20 603
603








