Химическая кинетика изучает вопросы скорости химических превращений. Одни реакции протекают мгновенно, тогда как другие могут длиться часы и годы. Важно уметь влиять на скорость реакции. Увеличить скорость химической реакции можно, например, повысив температуру проведения процесса. От скорости реакции зависит выбор размера реактора и его производительность.
Для гомогенной среды скоростью химической реакции 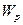 называют количество вещества, израсходованного или получаемого в ходе реакции в единице объема за единицу времени. В этом случае скорость реакции пропорциональна изменению концентрации С вещества, вступившего в реакцию или образующегося при реакции за единицу времени:
называют количество вещества, израсходованного или получаемого в ходе реакции в единице объема за единицу времени. В этом случае скорость реакции пропорциональна изменению концентрации С вещества, вступившего в реакцию или образующегося при реакции за единицу времени:
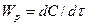 .
.
Для гетерогенной среды скоростью химической реакции называют количество вещества, израсходованного или получаемого в ходе реакции при единичной площади поверхности раздела фаз за единицу времени. Скорость химической реакции зависит от природы реагирующих веществ, их концентрации, температуры и присутствия катализатора.
В химической кинетике часто используют формализованное описание химической реакции. Уравнение реакции записывают в виде стехиометрического уравнения, которое может выглядеть, например, следующим образом:
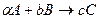 , (24.1)
, (24.1)
где а, b, с — стехиометрические коэффициенты соответствующих веществ.
Константа скорости реакции | зависит от природы реагирующих веществ, температуры и присутствия катализатора и определяется по уравнению Аррениуса
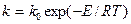 , (24.2)
, (24.2)
где 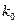 — коэффициент; Е — энергия активации, Дж/кмоль; R — универсальная газовая постоянная, R = 8310 Дж/(кмоль • К); Т — температура, К.
— коэффициент; Е — энергия активации, Дж/кмоль; R — универсальная газовая постоянная, R = 8310 Дж/(кмоль • К); Т — температура, К.
Скорость реакции определяется числом соударений реагирующих веществ, которое, в свою очередь, зависит от концентрации реагирующих веществ. Для реакции, протекающей в соответствии
с уравнением (24.1), скорость по веществу А определяется c помощью уравнения
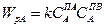 ,
,
где 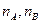 — показатели, называемые порядком реакции и равные, стехиометрическим коэффициентам а и b в уравнении (24.1). На пример, для реакции окисления оксида азота
— показатели, называемые порядком реакции и равные, стехиометрическим коэффициентам а и b в уравнении (24.1). На пример, для реакции окисления оксида азота
2NO + О2 = 2NО2
уравнение для скорости реакции имеет вид
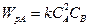
Мерой глубины химической реакции является степень превращения вещества 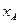 , которая показывает долю исходных веществ прореагировавших в данной реакции. В случае если в реакции участвует не один, а несколько реагентов, степень превращения определяют по каждому реагенту.
, которая показывает долю исходных веществ прореагировавших в данной реакции. В случае если в реакции участвует не один, а несколько реагентов, степень превращения определяют по каждому реагенту.
Другой важной характеристикой эффективности проведения процесса является выход продукта — отношение реально полученного количества продукта к теоретически возможному.
Поскольку в ходе проведения химической реакции кроме целевого продукта часто образуются и побочные продукты, в химической технологии используют такую характеристику процесса, как селективность — отношение количества исходного вещества израсходованного на получение необходимого продукта, к общему количеству исходного вещества, вступившего в химическое взаимодействие.
Степень превращения вещества, выход продукта и селективность являются безразмерными характеристиками эффективности химических реакций и изменяются в интервале от нуля до единицы.
Для того чтобы подойти к вопросу конструирования и выбора химического реактора, необходимо уметь правильно составлять уравнения материального и теплового балансов.
Порядок составления таких уравнений рассмотрен в гл. 1. Здесь отметим, что для определения количества теплоты, образующейся в результате проведения химической реакции, можно воспользоваться уравнением
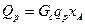 ,
,
где 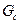 — массовый расход вещества, участвующего в химической реакции;
— массовый расход вещества, участвующего в химической реакции; 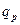 — тепловой эффект реакции, значение которого зависит от конкретной реакции и находится из справочной литературы;
— тепловой эффект реакции, значение которого зависит от конкретной реакции и находится из справочной литературы; 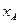 — степень превращения вещества А.
— степень превращения вещества А.
Для поддержания скорости реакции на высоком уровне необходимо грамотно управлять химическим процессом. Выбор способа управления зависит от типа реакции.
Различают следующие способы управления процессом: управление временем его проведения, концентрациями реагирующих веществ, температурным режимом процесса; создание развитой межфазной поверхности; поддержание требуемой активности катализатора (для каталитических реакций).
Управлять временем проведения процесса можно, осуществляя его в периодическом, непрерывном, полупериодическом и сменно-циклическом режимах.
Управление концентрациями реагирующих веществ достигается несколькими путями: рециркуляцией непревращенного сырья (подачей его на вход реактора), подводом сырья в разные точки реакционного объема и секционированием рабочего объема реактора.
Управлять температурным режимом можно путем проведения химического процесса в адиабатическом, изотермическом или политропическом режиме.
При осуществлении гетерогенных процессов важно создание развитой межфазной поверхности. Для реакций в системе газ— жидкость это может быть достигнуто путем интенсивного диспергирования газа в жидкости.
При проведении каталитических реакций необходимо поддержание активности катализатора на высоком уровне, что достигается его циркуляцией или регенерацией, а если этого недостаточно, то полной или частичной заменой.
Контрольные вопросы
1.Что изучает химическая кинетика? Что представляет собой химическая реакция? Какие бывают реакции?
2.От каких факторов зависит скорость химической реакции?
3.Какие требования предъявляют к конструкциям химических реакторов?
4.Приведите определения таких понятий, как степень превращения вещества, выход продукта и селективность.
5.Каким образом можно управлять химическим процессом в реакторе?
Глава 25
 2015-05-05
2015-05-05 949
949








