6. Получение из природных источников. Соединения с сопряженными тройными связями выделены из сложноцветных, зонтичных растений. Например, из подсолнечника выделен углеводород желтого цвета -тридецен-1-пентаин-3,5,7,9,11:

19.Хим.св.алкинов. Р присоед: гидрирование; взаим.с электрофильными реагентами; о Марковников. Алки́ны — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обуславливает кислотные свойства алкинов в реакциях замещения.Обусловлены С-Сπ связями (присоединение) и Сsp- Н связью (кислотные свойства). Электрофильное присоединение. Алкины в реакциях с электрофильными реагентами взаимодействуют аналогично алкенам, по тому же механизму электрофильного присоединенияк С-Сπ связи. Однако реакции этого типа идут труднее из-за компактной π-МО и более прочной С-Сπ связи в алкинах по сравнению с алкенами. т.о. Число электрофильных реагентов, способных присоединяться к алкинам, значительно уменьшается за счёт исключения слабых электрофилов.Галогены (Сl2,Вr2,I2) присоед.к алкинам, но с меньшей ск.,чем к алкенам; обычно присоед.две молекулы калогена:
CH3 ⁄ ⁄ Br
СН3-С≡ →Вr2 C═C
∕ ⁄ H
Вr Присоед.галогеноводородов. Они присоед.к алкинам так же как и к алкенам,но алкины могут присоед.одну или две молекулы галогеноводорода: обе молекулы галогеноводорода присоед.по правилу Марковникова
/Br
СН3—С≡СН +Вr→СН3—С=СН2→HВr СН3--С--СН3
⁄ /
Вr Вr
2-бромпропен 2,2-дибромпропан
20.Хим св-ва Алки́ны — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обуславливает кислотные свойства алкинов в реакциях замещения. Реакции присоединения: 1) присоединение водорода (гидрирование). На I ступени образуются алкены, на II ступени – алканы.2) присоединение галогенов (галогенирование). HC≡CH + HCl → CH2=CHCl → CH3-CHCl2; На I ступени образуются дигалогеналкены, на II – тетрагалогеналканы.Реакция алкинов с бромной водой – качественная реакция на алкины. Бромная вода обесцвечивается;3) присоединение галогеноводородов (гидрогалогенирование).На I ступени образуются моногалогеналкены, на II – дигалогеналканы;4) присоединение воды (гидратация).Ацетилен образует альдегид, его гомологи – кетоны (реакция М.Г. Кучерова): Явление, когда вещество может существовать в виде нескольких изомерных форм, легко переходящих друг в друга и находящихся в динамическом равновесии, называют таутомерией. Переходящие друг в друга формы называются таутомерами, а их взаимный переход - таутомерным превращением. Таутомерные превращения характерны для многих классов органических соединений. Изложение материала, затрагивающего таутомерные системы, безусловно должно опираться на такие понятия, как взаимное влияние атомов в молекулах, скорость химических реакций, динамическое равновесие, влияние растворителей на состояние равновесия, термодинамическая устойчивость органических веществ, механизмы органических реакций. Поэтому изучение данного материала позволит представить органическую химию как целостную науку.Понятие таутомерии сформировалось еще в XIX веке, причем формирование его происходило достаточно обычным для химии методом - методом проб и ошибок. В 1865 году Ф. Кекуле предложил для бензола циклическую формулу с чередующимися двойными и одинарными связями. Эта формула предусматривала возможность существования следующих изомеров: ЭЛЬТЕКОВА ПРАВИЛО: ненасыщенные спирты с группой ОН у атома углерода, при к-ром имеется двойная связь (см. Енолы), нестойки и превращаются в карбонильные соед. (альдегиды или кетоны): Эльтекова правило в определенной мере справедливо лишь для простейших енолов. Известны многочисленные достаточно стабильные енолы[напр., соед. ф-лы I, СН3С(ОН) = =CHC(О)Ph, HOCH = C(COOC2H5)2 содержат соотв. 100, 99 и 94% енольной формы], а также соед., в к-рых енольная и карбонильная формы находятся в динамич. равновесии (см. Таутомерия).
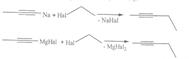
21.Хим. св-ва алкинов.Кислот. св-ва. Ацетилениды Mg, Na, Li часто используют в орг-ком синтезе для введения этинильной группы. При взаимод. с алкилиру-ющими агентами обр. алкилацетилены (метилацетилен, 1-бутин, 1-пентин): RX + МССН → RCCH + MX.Ацетиленид Cu (I) — красно-кор., черные кристаллы. В сухом виде детонируют при ударе или нагреве, в отсутствие О2 не образуется газообр. в-в. Образуется в виде осадка при пропускании ацетилена в аммиачные р-ры солей меди(I). C2H2 + 2CuCl → Cu2C2 + 2HCl. Ацетиленид Ag — оч. неустойч. белое кристал. взрывчатое в-во. Пропустим через аммиач. р-р оксида Ag ацетилен. Выпадает осадок беловатого цвета - ацетиленид серебра.



 2015-05-06
2015-05-06 874
874







