Основные типы движений в молекулах.
В общем случае в молекуле (М) имеется три типа движений: электронное, колебательное и вращательное. Движение каждого Э в М происходит в электрическом поле атомных ядер и в поле всех других Э. Так же как и в атомах в М электроны образуют вполне определенные конфигурации, а электронная энергия 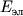 квантуется. Состояние М, соответствующее определенному значению
квантуется. Состояние М, соответствующее определенному значению 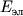 , наз. электронным состоянием. В отличие от атомов, в М
, наз. электронным состоянием. В отличие от атомов, в М 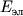 в каждом электронном состоянии не явл. определенной постоянной величиной, но зависит от межъядерных расстояний (длин связи) и углов между ними (валентных углов). Эта функциональная зависимость наз. поверхностью потенциальной энергии (или кривой потенциальной энергии для двух атомной М). Поверхность потенциальной энергии, соответствующая связанному состоянию М, имеет минимум при некоторых значениях длин связи и валентных углов - эти значения наз. равновесными. Классификация электронных состояний многоатомных М проводится методами теории групп.
в каждом электронном состоянии не явл. определенной постоянной величиной, но зависит от межъядерных расстояний (длин связи) и углов между ними (валентных углов). Эта функциональная зависимость наз. поверхностью потенциальной энергии (или кривой потенциальной энергии для двух атомной М). Поверхность потенциальной энергии, соответствующая связанному состоянию М, имеет минимум при некоторых значениях длин связи и валентных углов - эти значения наз. равновесными. Классификация электронных состояний многоатомных М проводится методами теории групп.
Наиболее простыми системами с точки зрения классификации энергетических состояний явл. линейные, или двухатомные М. В линейной М электрическое поле, действующее на Э, обладает аксиальной симметрией. Поэтому каждое электронное состояние характеризуется определенным значением проекции суммарного орбитального МКД всех Э на ось М. Эта величина обозначается 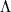 . Различным значениям абс. величины
. Различным значениям абс. величины 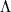 соответствуют различные электронные состояния, или термы, к-рые обозначаются большими буквами греч. алфавита:
соответствуют различные электронные состояния, или термы, к-рые обозначаются большими буквами греч. алфавита: 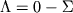 -состояние,
-состояние, 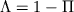 -состояние,
-состояние, 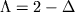 -состояние и т.д. Электронные состояния характеризуются также суммарным спином всех электронов S. Спин-орбитальное взаимодействие приводит к расщеплению электронного терма с данным S на 2 S +1 близко лежащих У.э. (тонкая структура). Число 2 S +1 наз. мультиплетностью электронного терма и ставится слева вверху у греч. буквы, указывающей значение
-состояние и т.д. Электронные состояния характеризуются также суммарным спином всех электронов S. Спин-орбитальное взаимодействие приводит к расщеплению электронного терма с данным S на 2 S +1 близко лежащих У.э. (тонкая структура). Число 2 S +1 наз. мультиплетностью электронного терма и ставится слева вверху у греч. буквы, указывающей значение 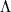 , напр.,
, напр., 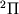 ,
, 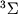 . Опыт показывает, что осн. электронное состояние большинства М есть
. Опыт показывает, что осн. электронное состояние большинства М есть 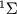 -состояние. Существует, однако, ряд М, в т.ч. такие межзвездные М как OH, NO, CH, осн. состояние к-рых характеризуется отличными от нуля значениями L или/и S.
-состояние. Существует, однако, ряд М, в т.ч. такие межзвездные М как OH, NO, CH, осн. состояние к-рых характеризуется отличными от нуля значениями L или/и S.
При 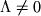 возможны два состояния с одинаковой энергией, отличающиеся знаком проекции орбиального МКД на ось М (
возможны два состояния с одинаковой энергией, отличающиеся знаком проекции орбиального МКД на ось М (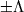 ). Т.о., все состояния с
). Т.о., все состояния с 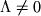 двухкратно вырождены.
двухкратно вырождены. 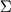 -состояния не вырождены. Различают
-состояния не вырождены. Различают 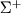 - и
- и 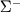 -состояния. Знаки
-состояния. Знаки 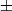 обозначают четность состояния по отношению к операции отражения в плоскости, содержащей ось М. Если М обладает центром симметрии (напр., H2, O2, CO2, H2C2), то появляется дополнит. квантовое число - четность по отношению к инверсии пространства. Четные состояния обозначают индексом
обозначают четность состояния по отношению к операции отражения в плоскости, содержащей ось М. Если М обладает центром симметрии (напр., H2, O2, CO2, H2C2), то появляется дополнит. квантовое число - четность по отношению к инверсии пространства. Четные состояния обозначают индексом 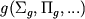 , а нечетные - индеском
, а нечетные - индеском 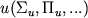 .
.
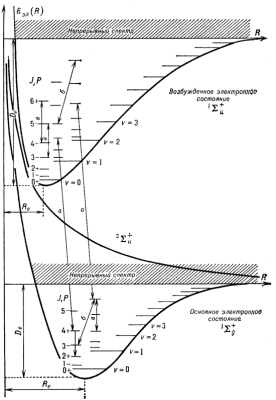
Осн. св-ва кривых потенциальной энергии иллюстрируются рис. 3, где показаны такие кривые для трех электронных состояний молекулы H2 - 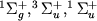 (для наглядности масштабы по осям энергии и межъядерных расстояний не выдержаны точно). Кривые для
(для наглядности масштабы по осям энергии и межъядерных расстояний не выдержаны точно). Кривые для 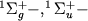 состояний имеют минимумы при равновесных межъядерных расстояниях R=Re и соответствуют связанным состояниям М. При
состояний имеют минимумы при равновесных межъядерных расстояниях R=Re и соответствуют связанным состояниям М. При 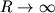 оба атома водорода свободны и E эл равна сумме энергий обоих атомов. Величина
оба атома водорода свободны и E эл равна сумме энергий обоих атомов. Величина 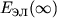 наз. границей диссоциации. При сближении атомов образуется устойчивая М. Когда R < Re, потенциальная энергия растет, т.к. начинает сказываться кулоновское отталкивание ядер. Разность энергий
наз. границей диссоциации. При сближении атомов образуется устойчивая М. Когда R < Re, потенциальная энергия растет, т.к. начинает сказываться кулоновское отталкивание ядер. Разность энергий 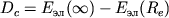 наз. энергией диссоциации. Кривая потенциальной энергии для состояния
наз. энергией диссоциации. Кривая потенциальной энергии для состояния  не имеет минимума, т.е. это состояние не явл. связанным. Сближающиеся атомы с таким набором квантовых чисел после столкновения расходятся, и М не образуется.
не имеет минимума, т.е. это состояние не явл. связанным. Сближающиеся атомы с таким набором квантовых чисел после столкновения расходятся, и М не образуется.
Колебания молекулы.
Из вида потенциальной кривой для связанного состояния М ясно, что при уменьшении или увеличении межъядерного расстояния относительно равновесного появляется сила, стремящаяся вернуть ядра в положение равновесия, R=Re. Эта сила приводит к возникновению колебательного движения ядер.
В многоатомных М колебательные движения ядер заключаются в периодическом изменении длин связей и валентных углов относительно их равновесных значений. Колебательное движение квантуется, что приводит к возникновению дискретного колебательного энергетического спектра. Каждый колебательный У.э. двухатомной М (число колебательных степеней свободы i =1 - одномерное движение) характеризуется квантовым числом v, а энергия уровня равна:
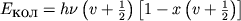 , v =0, 1, 2,..., (4)
, v =0, 1, 2,..., (4)
где  и x - осн. частота и постоянная ангармонизма; эти константы отличаются для различных электронных состояний. Многоатомные М, состоящие из N атомов имеют число колебательных степеней свободы
и x - осн. частота и постоянная ангармонизма; эти константы отличаются для различных электронных состояний. Многоатомные М, состоящие из N атомов имеют число колебательных степеней свободы 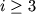 i=3N-5 для линейных М и i=3N-6 для нелинейных). Каждый колебательный У.э. в этом случае характеризуется набором колебательных квантовых чисел (v 1, v 2,..., v i), а энергия E кол определяется приближенным выражением:
i=3N-5 для линейных М и i=3N-6 для нелинейных). Каждый колебательный У.э. в этом случае характеризуется набором колебательных квантовых чисел (v 1, v 2,..., v i), а энергия E кол определяется приближенным выражением:
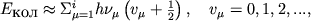 (5)
(5)
где 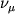 - осн. частоты (иногда их наз. частотами нормальных колебаний). Уровни колебательной энергии для М высокой степени симмтерии могут быть дважды и трижды выроженными.
- осн. частоты (иногда их наз. частотами нормальных колебаний). Уровни колебательной энергии для М высокой степени симмтерии могут быть дважды и трижды выроженными.
Положение колебательных У.э. двухатомной М показаны на рис. 3 горизонтальными линиями у правых ветвей кривых потенциальной энергии E кол(R). Колебательные У.э. сгущаются к границе диссоциации 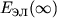 , но их число конечно в отличие от атомных уровней, для к-рых главное квантовое число n может принимать какие угодно большие значения. Выше границы диссоциации лежит непрерывный энергетический спектр, соответствующий диссоциированному состоянию: полная энергия свободных атомов может принимать произвольные значения.
, но их число конечно в отличие от атомных уровней, для к-рых главное квантовое число n может принимать какие угодно большие значения. Выше границы диссоциации лежит непрерывный энергетический спектр, соответствующий диссоциированному состоянию: полная энергия свободных атомов может принимать произвольные значения.
Вращение молекул.
Вращательное движение М как целого можно приближенно рассматривать как повороты твордого тела вокруг нек-рой оси. Вращат. движение квантуется, что приводит к возникновению дискретного вращательного энергетического спектра. Каждый вращат. У.э. характеризуется вращат. энергией E вр, вращат. МКД J, четностью P и некоторыми дополнительными квантовыми числами, к-рые часто оказываются необходимыми для описания вращения нелинейных М.
В общем случае многоатомная М имеет три главных момента инерции I 1, I 2, I 3, относительно трех взаимно перпендикулярных осей, связанных с М. Для линейной М 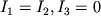 (ось 3 в данном случае совпадает с осью М). Вращение такой М происходит вокруг оси, перпендикулярной оси М. Вращат. энергия приближенно определяется ф-лой:
(ось 3 в данном случае совпадает с осью М). Вращение такой М происходит вокруг оси, перпендикулярной оси М. Вращат. энергия приближенно определяется ф-лой:
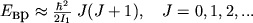 (6)
(6)
Этой же ф-лой определяется энергия уровней М типа сферич. волчка, у к-рой I 1= I 2= I 3 (напр., CH4, CF4). Если 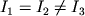 , то М относится к типу симметричных волчков (напр., NH3, CH3CN). Ее У.э. характеризуются не только значениями вращат. МКД J, но и дополнительным квантовым числом - проекцией J на ось симметрии М. Эта величина обычно обозначается буквой K. Энергия вращат. У.э. в этом случае:
, то М относится к типу симметричных волчков (напр., NH3, CH3CN). Ее У.э. характеризуются не только значениями вращат. МКД J, но и дополнительным квантовым числом - проекцией J на ось симметрии М. Эта величина обычно обозначается буквой K. Энергия вращат. У.э. в этом случае:
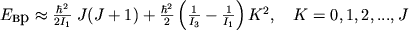 . (7)
. (7)
Если же все три момента инерции различны, М относится к типу асимметричных волчков (напр., H2O, H2CO). Для характеристики ее вращат. У.э. требуется задание двух дополнительных квантовых чисел, энергия вращат. уровней не может быть выражена простыми ф-лами типа (6) или (7) и рассчитывается спец. методами.
Вращат. У.э. двухатомной М в 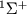 -состояниях показаны на рис. 3 для двух колебательных состояний терма
-состояниях показаны на рис. 3 для двух колебательных состояний терма 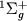 и трех колебательных состояний терма
и трех колебательных состояний терма 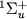 . Аналогичная вращат. структура (или полоса) имеется у всех х колебательных состояний. Энергия вращат. уровней отсчитывается от положения х колебательного уровня, к-рому принадлежит данная вращат. полоса. Если М имеет тождественные ядра (как, напр., H2), это приводит к определенным ограничениям на существования вращат. У.э. с различными значениями J. В М водорода оба ядра (протоны) имеют спины 1/2. Полный ядерный спин может принимать два значения: I =0 (параводород) и I =1 (ортоводород). В этом случае, как следует из квантовомеханич. рассмотрения, все вращат. У.э. с четными J в
. Аналогичная вращат. структура (или полоса) имеется у всех х колебательных состояний. Энергия вращат. уровней отсчитывается от положения х колебательного уровня, к-рому принадлежит данная вращат. полоса. Если М имеет тождественные ядра (как, напр., H2), это приводит к определенным ограничениям на существования вращат. У.э. с различными значениями J. В М водорода оба ядра (протоны) имеют спины 1/2. Полный ядерный спин может принимать два значения: I =0 (параводород) и I =1 (ортоводород). В этом случае, как следует из квантовомеханич. рассмотрения, все вращат. У.э. с четными J в 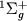 -состоянии относятся к параводороду, а в
-состоянии относятся к параводороду, а в 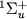 -состоянии - к ортоводороду. Наоборот, уровни с нечетными J в
-состоянии - к ортоводороду. Наоборот, уровни с нечетными J в 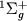 -состоянии относятся к ортоводороду, а в
-состоянии относятся к ортоводороду, а в 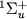 -состоянии - к параводороду. Четности вращат. состояний на рис. 3 указаны рядом со значениями J.
-состоянии - к параводороду. Четности вращат. состояний на рис. 3 указаны рядом со значениями J.
Полная энергия молекулы определяется приближенно как сумма всех видов энергии:
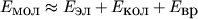 . (8)
. (8)
Причем, как правило, выполняются неравенства
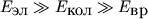 , и
, и
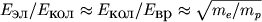 , (9)
, (9)
где mp - масса протона.
Типы переходов в молекулах.
В соответствии со структурой энергетич. состояний в М различают три осн. типа квантовых переходов (здесь коснемся только радиац. переходов).
|
Рис. 3. Схематическое изображение структуры трех электронных состояний орто- и парамолекул H2. Для связанных электронных состояний  и и 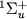 обозначены положения колебательных (v=0, 1, 2,...) и вращательных (J=0, 1, 2,...) уровней энергии, а также их четности P. Линии со стрелками показывают возможные типы переходов: а - электронно-колебательно-вращательные, б - колебательно-вращательные, в - вращательные. обозначены положения колебательных (v=0, 1, 2,...) и вращательных (J=0, 1, 2,...) уровней энергии, а также их четности P. Линии со стрелками показывают возможные типы переходов: а - электронно-колебательно-вращательные, б - колебательно-вращательные, в - вращательные.
|
Электронно-колебательно-вращательные переходы (переходы типа а на рис. 3).
Длины волн этих переходов обычно лежат в УФ- и оптич. областях спектра. Для H2 переходы типа а относятся к серии Лаймана и имеют длины волн ок. 1000-1100 ангстрем. Они наблюдаются как в межзвездной среде нашей Галактики, так и в др. галактиках и, в частности, в облаках газа, имеющих большие красные смещения. В последнем случае они могут наблюдаться методами оптич. астрономии.
Колебательно-вращательные переходы (переходы типа б на рис. 3).
Их длины волн попадают, как правило, в ИК-область спектра. Напр., колебательный переход 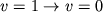 в H2 в осн. электронном состоянии имеет длину волны
в H2 в осн. электронном состоянии имеет длину волны 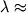 2,28 мкм и наблюдается в плотных и горячих источниках связанных с областями звездообразования.
2,28 мкм и наблюдается в плотных и горячих источниках связанных с областями звездообразования.
Вращательные переходы (переходы типа в на рис. 3).
Их длины волн попадают в ИК-, субмиллиметровую и микроволновую область спектра. Напр., в межзвездной среде наблюдаются вращат. переходы H2 с длиной волны 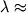 28 мкм (переход
28 мкм (переход 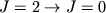 ), субмиллиметровые переходы CO на волне
), субмиллиметровые переходы CO на волне 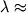 0,87 мм (переход
0,87 мм (переход 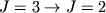 ). Радиоастрономич. методами обнаружено более 600 вращат. линий различных межзвездных М (см. Молекулы в межзвездной среде).
). Радиоастрономич. методами обнаружено более 600 вращат. линий различных межзвездных М (см. Молекулы в межзвездной среде).
Некоторые важные типы расщеплений молекулярных состояний.
Помимо осн. электронно-колебательно-вращател. структуры У.э. молекулы имеется ряд дополнит. расщеплений, играющих важную роль в интерпретации спектров межзвездных М. Кратко рассмотрим лишь нек-рые из них.
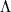 -расщепление (
-расщепление (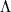 -удвоение) обязано взаимодействию между вращательным и электронным движениями в М, находящихся в
-удвоение) обязано взаимодействию между вращательным и электронным движениями в М, находящихся в 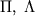 и т.п. состояниях, т.е. когда проекция орбитального МКД электронов на ось М отлична от нуля. Важный пример этого типа расщепления приведен на рис. 4, где показана структура нижних вращател. У.э. межзвездной молекулы OH. Во внеш. электронной оболочке молекулы OH находится один электронЮ так что полный электронный спин S =1/2. Поэтому осн. состояние
и т.п. состояниях, т.е. когда проекция орбитального МКД электронов на ось М отлична от нуля. Важный пример этого типа расщепления приведен на рис. 4, где показана структура нижних вращател. У.э. межзвездной молекулы OH. Во внеш. электронной оболочке молекулы OH находится один электронЮ так что полный электронный спин S =1/2. Поэтому осн. состояние 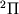 расщеплено спин-орбитальным взаимодействием на две вращател. полосы:
расщеплено спин-орбитальным взаимодействием на две вращател. полосы: 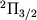 и
и 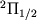 . Нижний индекс у знака терма обозначает суммарную проекцию
. Нижний индекс у знака терма обозначает суммарную проекцию 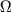 орбитального и спинового МКД на ось М. В данном случае (
орбитального и спинового МКД на ось М. В данном случае (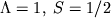 )
) 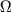 может принимать два значения:
может принимать два значения: 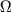 =1/2 и
=1/2 и  =3/2.
=3/2.
|
Рис. 4. Нижние уровни молекулы OH, 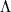 -расщепление и сверхтонкое расщепление. Справа внизу приведено распределение электронной плотности, поясняющее образование -расщепление и сверхтонкое расщепление. Справа внизу приведено распределение электронной плотности, поясняющее образование 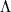 -дублета. Стрелками указаны переходы, к-рые наблюдаются в межзвездной среде. -дублета. Стрелками указаны переходы, к-рые наблюдаются в межзвездной среде.
|
Т.к. для двухатомной М вращател. момент перпендикулярен молекулярной оси, то полнй МКД, слагающийся из электронного и вращател. МКД, не может быть меньше 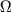 . Поэтому для J возможны следующие наборы значений: J =1/2, 3/2,... для полосы
. Поэтому для J возможны следующие наборы значений: J =1/2, 3/2,... для полосы 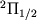 и J =3/2, 5/2,... для полосы
и J =3/2, 5/2,... для полосы 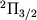 . В каждой вращател. полосе все вращател. У.э. удвоены. Причину этого удвоения качественно можно понять, рассматривая распределение электронной плотности в молекуле OH относительно оси вращения. Взаимодействие между вращательными и электронными движениями приводит к двум возможным распределениям электронной плотности, показанным в нижней части рис. 4. Моменты инерции, а следовательно, и вращател. энергии в этих двух состояниях несколько отличаются. Поэтому каждый вращател. У.э. оказывается расщепленным на два подуровня (
. В каждой вращател. полосе все вращател. У.э. удвоены. Причину этого удвоения качественно можно понять, рассматривая распределение электронной плотности в молекуле OH относительно оси вращения. Взаимодействие между вращательными и электронными движениями приводит к двум возможным распределениям электронной плотности, показанным в нижней части рис. 4. Моменты инерции, а следовательно, и вращател. энергии в этих двух состояниях несколько отличаются. Поэтому каждый вращател. У.э. оказывается расщепленным на два подуровня (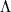 -удвоение), четности к-рых противоположны.
-удвоение), четности к-рых противоположны.
Сверхтонкое расщепление.
Если одно или неск. ядер в М имеют отличные от нуля спины, то каждый вращател. У.э. расщепляется на систему сверхтонких подуровней (сверхтонкая структура). В этом случае каждый У.э. характеризуется полным МКД молекулы (F). Напр., в молекуле OH ядро атома водорода имеет спин I= 1/2, к-рый может быть направлен параллельно или антипараллельно моменту J (стрелки у атома H на рис. 4). В соответствии с правилами сложения моментов F может принимать значения 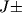 1/2, к-рые указаны на рис. 4. На этом рис. указаны такэже переходы, к-рым соответствуют радиолинии молекулы OH, наблюдаемые в межзвездной среде.
1/2, к-рые указаны на рис. 4. На этом рис. указаны такэже переходы, к-рым соответствуют радиолинии молекулы OH, наблюдаемые в межзвездной среде.
Инверсионное расщепление обязано т.н. заторможенным движениям в М. Эти движения связаны с квантовомеханическим туннельным эффектом. На рис. 5 показано осн. электронное состояние М аммиака NH3. Кривая потенциальной энергии имеет два минимума, что соответствует двум возможным положениям атома азота относительно плоскости, в к-рой лежат атомы водорода (r - расстояние от атома азота до этой плоскости). Если атом N находится в одном из минимумов кривой потенциальной энергии, то переход в др. минимум в класси. механике энергетически невозможен. В квантовой механике такой переход возможен за счет туннельного эффекта - частица туннелирует под энергетич. барьером, что изображено волнистой линией. Т.о., два минимума потенциальной энергии оказываются связанными между собой. Согласно квантовой механике, такая связь приводит к расщеплению каждого колебательного уровня энергии, лежащего ниже центрального максимума, на два подуровня. Это расщепление наз. инверсионным. Поскольку каждому колебательному У.э. соответствует своя вращател. полоса, то двум инверсионным подуровням будут соответствовать две слегка смещенные (на величину расщепления) полосы, как это показано на рис. 5 справа, где изображен участок вращател. спектра осн. колебательного состояния аммиака. Т.к. NH3 относится к М типа симметричного волчка, то энергии вращател. уровней можно приближенно определить по ф-ле (7) для любых J и K. М аммиака имеет три тождественных ядра. В силу принципа Паули нек-рые вращател. У.э. оказываются запрещенными (подобно тому, что имеет место для орто- и параводорода). Эти У.э. обозначены штриховыми линиями. Линии, соответствующие переходам между инверсионными подуровнями (они обозначены стрелками на рис. 5), попадают в радиодиапазон вблизи частоты 23 ГГц и наблюдаются в межзвездной среде.
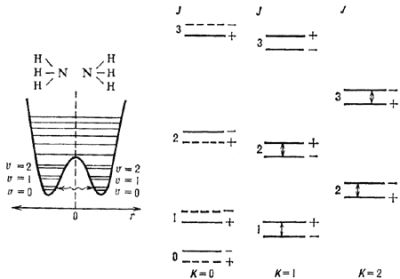
|
| Рис. 5. Структура вращательных уровней и инверсионное расщепление в молекуле аммиака. Стрелками показаны переходы, наблюдаемые в межзвездной среде. |
Их изучение играет важную роль в исследованиях плотных и холодных облаков межзвездного газа.
 2015-05-06
2015-05-06 1541
1541
