Задание на практическую работу №1.
Количество тепла, заключенное в каком-либо теле, увеличивается (или уменьшается) при изменении его температуры. Коэффициент пропорциональности между количеством подведенной к телу теплоты и изменением его температуры называется теплоемкостью 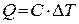 . Удобнее пользоваться понятием теплоемкости, отнесенной к единице массы
. Удобнее пользоваться понятием теплоемкости, отнесенной к единице массы 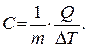 Удельной теплоемкостью какого-либо тела называется количество тепла, которое необходимо сообщить единице массы (или объема), чтобы повысить его температуру на 1 градус.
Удельной теплоемкостью какого-либо тела называется количество тепла, которое необходимо сообщить единице массы (или объема), чтобы повысить его температуру на 1 градус.
Как правило, теплоемкость всех тел (твердых, жидких и газообразных) зависит от температуры. Для газов, в отличие от твердых и жидких тел, теплоемкость в сильной степени зависит и от других внешних параметров (давление, объем), при которых происходит отнятие или сообщение тепла. Поэтому для газов различают теплоемкость при постоянном давлении 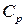 и теплоемкость при постоянном объеме
и теплоемкость при постоянном объеме 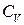 . Теплоемкость при постоянном давлении больше теплоемкости при постоянном объеме. Соотношения между ними характеризуются следующими равенствами:
. Теплоемкость при постоянном давлении больше теплоемкости при постоянном объеме. Соотношения между ними характеризуются следующими равенствами:
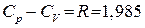 ;
; 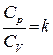 ,
,
где R – универсальная газовая постоянная, кал/моль·град.; k – показатель адиабаты рассматриваемого газа.
Величина показателя адиабаты k зависит от структуры молекул газа: для одноатомных газов (аргон, гелий и др.) 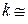 1,67, для двухатомных (кислород, азот, окись углерода)
1,67, для двухатомных (кислород, азот, окись углерода) 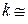 1,4, а для многоатомных (CO2, SO2, H2O и пр.)
1,4, а для многоатомных (CO2, SO2, H2O и пр.) 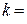 1,33.
1,33.
В инженерной практике чаще используется изобарная теплоемкость. Зависимость ее от температуры для различных газов в справочной литературе обычно задается уравнениями:
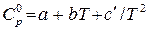 или
или 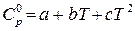 ,
,
по которым может быть определена истинная теплоемкость тела при любой температуре и построен график зависимости 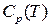 для рассматриваемого вещества. Площадь под кривой
для рассматриваемого вещества. Площадь под кривой 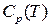 есть теплота, которой обладает вещество –
есть теплота, которой обладает вещество – 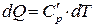 или
или 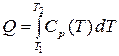 .
.
В инженерной практике обычно пользуются не истинными, а средними теплоемкостями. Средняя теплоемкость для заданного интервала температур представляет собой число, равное значению
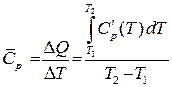 .
.
Определение энтропии
Важным параметром, определяющим состояние термодинамической системы, является энтропия. Этот параметр характеризует необратимость протекающих в термодинамической системе процессов и определяется по соотношению 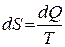 . Как было сказано ранее,
. Как было сказано ранее, 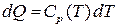 . Поэтому если известна функция изобарной теплоёмкости газа, значение его энтропии может быть определено путём интегрирования
. Поэтому если известна функция изобарной теплоёмкости газа, значение его энтропии может быть определено путём интегрирования 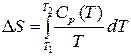 . Поскольку значение энтропии веществ при температуре
. Поскольку значение энтропии веществ при температуре 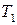 = 298,15 К известно, то величину
= 298,15 К известно, то величину 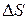 необходимо определить для интервалов температур 298–400, 298–500 и т.д., включая интервал указанный в задании для рассматриваемого газа.
необходимо определить для интервалов температур 298–400, 298–500 и т.д., включая интервал указанный в задании для рассматриваемого газа.
Абсолютное значение энтропии можно найти по выражению
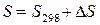 .
.
 2015-05-06
2015-05-06 683
683







