НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ И
СОЦИАЛЬНОГО РАЗВИТИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
(ГБОУ ВПО НГМУ Минздравсоцразвития России)
Фармацевтический факультет
Кафедра фармацевтической химии
АНАЛИТИЧЕСКАЯ ХИМИЯ. КАЧЕСТВЕННЫЙ АНАЛИЗ.
Методическое пособие для студентов заочного отделения фармацевтического факультета.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
РАЗДЕЛ 1 КАЧЕСТВЕННЫЙ АНАЛИЗ.
§ 1. Качественные реакции на катионы по кислотно-основной классификации.
1.1. Катионы I группы
1.2. Катионы II группы
1.3. Катионы III группы
1.4. Катионы IV группы
1.5. Катионы V группы
1.6. Катионы VI группы
§2. Систематический анализ катионов всех шести групп по кислотно-основной классификации.
§3. Качественные реакции на анионы.
3.1. Анионы первой группы
3.2. Анионы второй группы
3.3. Анионы третьей группы и некоторые органические анионы
Список рекомендуемой литературы
ВВЕДЕНИЕ
Аналитическая химия – это наука о принципах, методах и средствах определения состава вещества и в известной мере - их химического структуры, включающая в себя качественный и количественный химический анализ.
Проведение различных видов анализа является обязательной составляющей современного аптечного дела и фармацевтической промышленности. Химические и инструментальные методы анализа широко используются в фармации при анализе лекарственного сырья, лекарственных препаратов и лекарств. Аналитическая химия является необходимым фундаментом для дальнейшего изучения специальных дисциплин: фармацевтической химии, токсикологической химии, фармакогнозии.
Качественный химический анализ - это определение химических элементов, ионов, атомов, атомных групп, молекул и функциональных групп (например: карбоквильной – СООН и т.д.) в анализируемом веществе.
Качественный анализ является базой для изучения фармакопейного анализа, проводимого в рамках фармацевтического анализа. Фармакопейный анализ позволяет установить подлинность лекарственных веществ, его доброкачественность, входящих в состав лекарственных средств; он представляет собой совокупность способов и требований к исследованию лекарственных веществ, изложенных в Государственной фармакопее или другой нормативной документации. При отклонении от этих требований лекарственные средства к применению не допускаются. В дальнейшем, аналитические методики тщательно отработанные, проверенные экспертами (в России – Фармакопейным государственным комитетом, в США - Фармакопейной Конвенцией) и включенные в Государственную Фармакопею будем называть в данном пособии фармакопейными *.
При проведении качественного и количественного анализа используют аналитические признаки и аналитические реакции.
Аналитические признаки – такие свойства анализируемого вещества или продуктов его превращения, которые позволяют судить о наличии или отсутствии тех или иных компонентов.
Характерные аналитические признаки – цвет, запах, осадок, угол вращения плоскости поляризации, спектр поглощения в инфракрасной или ультрафиолетовой области света и т.д.
Аналитическая реакция – такое химическое превращение анализируемого вещества при действии аналитического реагента с образованием продукта с характерными аналитическими признаками.
Качественный химический анализ включает в себя дробный и систематический анализ.
Дробный анализ – обнаружение иона в анализируемой пробе с помощью специфического реагента в присутствии всех компонентов пробы.
Систематический анализ предусматривает разделение смеси анализируемых ионов по аналитическим группам с последующим обнаружением каждого иона. Существуют различные аналитические классификации катионов и анионов по группам; в данном пособии приведены наиболее часто использемые при проведении фармацевтического анализа.
РАЗДЕЛ 1. КАЧЕСТВЕННЫЙ АНАЛИЗ.
Основной задачей качественного химического анализа катионов и анионов является идентификация того или иного иона, т.е. доказательство его присутствия или отсутствия в анализируемом объекте.
В связи с применением различных групповых реагентов сформировались и различные аналитические классификации катионов по группам или различные химические методы качественного анализа катионов: сероводородный, аммиачно-фосфатный, кислотно-основной, карбонатный, сульфидно-основной, тиоцетамидный.
Наиболее распространенными являются три аналитические классификации по группам: сероводородная, аммиачно-фосфатная и кислотно-основная.
В пособии приведена кислотно-основная классификация катионов. Данная классификация катионов по группам основана на использовании в качестве групповых реагентов водных растворов кислот и оснований - хлороводородной кислоты, серной кислоты, гидроксидов натрия или калия и аммиака. Катионы, открываемые в рамках кислотно-основной классификации, подразделяют на шесть аналитических групп, которые будут рассмотрены в ходе лабораторных работ.
Кислотно-основная классификация катионов по группам.
| Группа | I | II | III | IV | V | VI |
| Катионы | Li+, Na+, K+, NH4+ | Ag+, Hg22+, Pb2+ | Ca2+, Sr2+, Ba2+ | Zn2+, Al3+, Sn2+, Sn4+, As3+, As5+, Cr3+ | Mg2+, Mn2+, Fe2+, Fe3+, Bi3+, Sb3+, Sb5+ | Cu2+, Hg2+, Cd2+, Co2+, Ni2+ |
| Групповой реагент | отсутствует | Водный раствор HCl | Водный раствор H2SO4 | Водный растовр NaOH (KOH) в присутствии Н2О2 | Водный раствор NaОН или 25%-й водный раствор аммиака | 25%-й водный раствор аммиака |
Как и катионы, многие анионы входят в состав лекарственных препаратов. При контроле качества лекарственных средств, технологических стадий их получения, лекарственного сырья и в ряде других случаев возникает необходимость качественного и количественного анализа анионов. Идентификацию анионов чаще всего проводят с использованием различных аналитических реакций, позволяющих открывать эти анионы.
Аналитическая классификация анионов по группам, в отличие от аналитической классификации катионов, разработана не столь подробно. Не существует общепризнанной и повсеместно принятой классификации анионов по аналитическим группам. Описаны различные классификации анионов.
Чаще всего принимают во внимание растворимость солей бария и серебра тех или иных анионов и их окислительно-восстановительные свойства в водных растворах.
В данном пособии аналитические реакции анионов будут рассматриваться со стороны классификации, основанной на образовании малорастворимых солей бария и серебра. Анионы этой классификации делят обычно на три группы.
Классификация анионов, основанная на образовании малорастворимых солей бария и серебра.
| Группа | I | II | III |
| Анионы | SO42-, SO32-, S2O32-, C2O42-, CO32-, B4O72-(BO2-), PO43-, AsO43-, AsO33-, F- | Cl-, Br-, I-, BrO3-, CN-, SCN-, S2-. | NO2-, NO3-, CH3COO- |
| Групповой реагент | Раствор BaCl2 в нейтральной или слабо щелочной среде | Раствор AgNO3 в разбавленной (2 моль/л) азотной кислоте | Отсутствует |
При открытии большинства анионов используются многие из тех аналитических реакций, которые применяются и для открытия катионов, особенно реакции осаждения и комплексообразования. Различие состоит в последовательности прибавления реагентов. При этом аналитическая реакция и продукты ее остаются теми же самыми.
§ 1. Качественные реакции катионов по кислотно-основной классификации.
1. Аналитические реакции катионов I аналитической группы по кислотно-основной классификации: Li+, Na+, K+, NH4+.
I аналитическая группа характеризуется отсутствием группового реагента, т.е. реактива, способного осаждать все катионы этой группы из их растворов.
1.1. Качественные реакции катионов Li+
1). Реакция с двузамещенным гидрофосфатом натрия
Среда нейтральная или слабощелочная
3Li+ + HPO42- = Li3PO4 ↓ + H+
Признаки реакции: белый осадок, растворимый в растворах кислот и солей аммония.
Предел обнаружения ~ 5 мкг.
2). Реакция с растворимыми карбонатами.
Среда нейтральная или щелочная
2Li+ + CO32- = Li2CO3 ↓
Признаки реакции: белый осадок, растворимый в растворах кислот.
Предел обнаружения~500 мкг.
3). Реакция с растворимыми фторидами.
Li+ + F- = LiF ↓
Признаки реакции: белый осадок, растворимый в уксусной кислоте.
Предел обнаружения~ 50 мкг.
4). Реакция (специфическая) с феррипериодатом калия.
Li+ + K2[FeIO6]= K+ + LiK[FeIO6]
Признаки реакции: бледно-желтый осадок.
5). Окрашивание пламени газовой горелки.
Соли лития окрашивают пламя горелки в карминово-красный цвет.
1.2. Качественные реакции катионов Na+
1). Реакция с дигидроантимонатом калия (или гексагидроксостибатом (V) калия).
Na++ KH2SbO4 = NaH2SbO4↓ + K+
Na+ + [Sb (OH)6]- = Na[Sb (OH)6]↓
Признаки реакции: белые кристаллические осадки.
Данная реакция применяется для осаждения ионов натрия из сыворотки крови или плазмы при йодометрическом определении натрия в крови.
2). Микрокристаллическая реакция с цинкуранилацетатом (фармакопейная)
Na+ + Zn(UO2)3(CH3COO)8 +CH3COO- + 9Н2О = NaZn(UO2)3(CH3COO)9*9H2O
Признаки реакции: желтый (или желто - зеленый) кристаллический осадок.
Реакция высокочувствительна – предел обнаружения 0,8 мкг.
3). Окрашивание пламени газовой горелки (фармакопейный тест).
Соли и другие соединения натрия окрашивают пламя в желтый цвет.
1.3. Качественные реакции К+
1). Реакция с гидротартратом натрия (фармакопейная) или (винной кислотой) в присутствии ацетата натрия в нейтральной среде.
К+ + NaHC4Н4O6 = KHC4H4O6 + Na+
Признаки реакции: белый кристаллический осадок.
Предел обнаружения-50 мкг, предельное разбавление 103 мл/г.
2). Реакция с гексанитрокобальтатом (III) натрия (фармакопейная).
Обнаружение иона К+ с помощью гексанитрокобальтата (III) натрия проводят в нейтральном и слабокислом растворах, так как в щелочной среде и в присутствии сильных кислот реагент разлагается.
2К+ + Na3[Co(NO2)6] = K2Na[Co(NO2)6] + 2Na+
Признаки реакции: желтый кристаллический осадок.
Предел обнаружения – 4 мкг, предельное разбавление 104 мл/г.
3). Реакция (микрокристаллоскопическая) с гексанитрокупратом (II) натрия и свинца.
2К+ + Na2Pb[Cu(NO2)6] = K2Pb[Cu(NO2)6] + 2Na+
Признаки реакции: черные кристаллы кубической формы.
Предел обнаружения 0,15 мкг. Предельное разбавление 6,6*103 мл/г.
4). Окрашивание пламени газовой горелки (фармакопейный тест).
Соли калия или их растворы окрашивают пламя в фиолетовый цвет.
1.4. Качественные реакции катионов NH4+
Следует иметь в виду, что приведенные выше реагенты, используемые для исследования растворов на содержание в них ионов калия и натрия, дают аналогичный эффект с катионом аммония. Поэтому использование этих реагентов возможно после предварительного испытания раствора на содержание в нем катиона аммония.
1). Разложение солей аммония щелочами (фармакопейная).
NH4+ + OH- = NH3↑ + H2O
Признаки реакции: характерный запах аммиака, окрашивание универсальной индикаторной бумаги в фиолетовый цвет
Предел обнаружения: 0,01 мкг, предельная концентрация 10-7 г/мл. Реакция специфична и высокочувствительна.
2). Реакция с реактивом Несслера (фармакопейная).
NH4+ + 2[HgI4]2- + 4OH-= [OНg2NH2]I + 7I- + 3H2O
Признаки реакции: красно-бурый осадок.
Предел обнаружения – 0,05-0,25 мкг.
2. Аналитические реакции катионов II аналитической группы по кислотно-основной классификации: Ag+, Hg22+, Pb2+.
2.1. Качественные реакции катионов Ag+
1). Реакция с соляной кислотой и растворимыми хлоридами (фармакопейная), бромидами и йодидами.
Ag+ + Cl- = AgCl ↓ (белый)
Ag+ + Br- = AgBr ↓ (желтоватый)
Ag+ + I- = AgI ↓ (желтый)
Растворимость в аммиаке:
а) Осадок AgCl растворяется полностью вследствие образования комплексного соединения [Ag(NH3)2]Cl. Аммиакат серебра легко разрушается кислотами. Содержание пробирки с аммиакатом серебра делят на 2 равные части. В одну – добавить 5-7 капель 2 н. раствора HNO3 ,в другую – 5-10 капель KI. При этом в первой пробирке осаждается хлорид серебра AgCl; а во второй пробирке осаждается иодид серебра AgI.
б) Осадок бромида серебра AgBr растворяется частично.
в) Осадок иодида серебра AgI – нерастворим в концентрированном аммиаке.
Осадок AgCl растворяется также в концентрированных растворах HCl и хлоридов, в присутствии цианида калия KCN, тиосульфата натрия Na2S2O3 с образованием растворимых комплексов:
AgCl + Cl-→ [AgCl2]-
AgCl + 2 KCN → K [Ag(CN)2] + KCl
AgCl + 2 Na2S2O3 → Na3 [Ag(S2O3)2] + NaCl
2). Реакция с хромат - ионами CrО42- (в нейтральной среде).
2 Ag+ + CrО42- = Ag2CrO4 ↓ (кирпично-красный).
· Осадок растворим в растворах кислот.
· Осадок также растворяется в концентрированном аммиаке с образованием аммиачного комплекса серебра:
Ag2CrO4 + 4 NH3 → [Ag (NH3)2]2CrO4
3). Реакция со щелочами и гидрофосфатом натрия.
2 Ag+ + 2 OH- = Ag2O ↓ (бурый или черный) + Н2О
3 Ag+ + 2 HPO42- = Ag3PO4 ↓ (желтоватый) + H2PO4-
4). Реакция серебряного зеркала – с формальдегидом (фармакопейная).
Ag+ + NH3*H2O) = AgOH ↓ + NH4+
2 AgOH = Ag2O + HOH
Ag2O + 4 NH3 + HOH = 2 [Ag(NH3)2]+ + 2 OH-
2 [Ag(NH3)2]+ + HCHO + 2 HOH = 2 Ag + 2 NH4+ + HCOONH4 + NH3* H2O
Признаки реакции: Стенки пробирки покрываются тонкой блестящей зеркальной пленкой металлического серебра.
5). Микрокристаллическая реакция с K2Cr2O7.
2 Ag+ + K2Cr2O7 = Ag2Cr2O7 + 2 K+
Признак реакции: Образуются крупные красно-бурые или оранжевые кристаллы Ag2Cr2O7.
Катионы серебра Ag+ реагируют также с другими веществами с образованием осадков: с сероводородом H2S – черно-коричневый осадок сульфида серебра Ag2S; с тиосульфатом натрия Na2S2O3 – белый осадок Ag2S2O3, растворимый в избытке реактива и т.д.
2.2. Качественные реакции катионов Hg22+.
1). Реакция с соляной кислотой и хлорид – ионами.
Hg22+ + 2 Cl- = Hg2Cl2 (каломель – белого цвета)
· На свету осадок постепенно чернеет с выделением тонкодисперсной металлической ртути:
Hg2Cl2 = HgCl2 + Hg.
· Такой же эффект наблюдается при действии (добавляют 5-6 капель) аммиака на осадок Hg2Cl2:
Hg2Cl2 + 2 NH4OH = [NH2Hg]Cl ↓ + Hg + NH4Cl + 2 H2O
2). Восстановление Hg22+ до металлической ртути хлоридом олова (II).
Hg2(NO3)2 + SnCl2 = Hg2Cl2 ↓ + Sn(NO3)2
Hg2Cl2 + SnCl2 = 2 Hg + SnCl4
Признаки реакции: Белый осадок каломели, постепенно чернеющей за счет выделения металлической ртути.
3). Восстановление Hg22+ металлической медью.
Hg22+ + Cu → 2 Hg + Cu2+
Признаки реакции: На поверхности свежеочищенной медной пластинки образуется серое пятно амальгамы меди, которое после обмыва и протирания фильтровальной бумагой, становится блестящим.
4). Реакция с водным раствором аммиака.
2 Hg2(NO3)2 + 4 NH3 + H2O = [OНg2NH2]NO3 + 2 Hg +3 NH4NO3.
Признаки реакции. Выпадает черный осадок.
5). Реакция со щелочами.
Hg22+ + 2 OH- = Hg2O ↓ + H2O
Признаки реакции: Выпадает черный осадок Hg2O. Осадок растворяется в азотной и концентрированной уксусной кислотах.
6). Реакция с йодидами.
Hg2(NO3)2 +2 KI = Hg2I2 (желто-зеленый) + 2 KNO3
Hg2I2 +2 I- =[ HgI4]2- + Hg ↓.
7). Реакция с хромат – ионами.
Hg22+ + CrO42- = Hg2CrO4 ↓ (красный)
2.3. Качественные реакции катионов Pb2+.
1). Реакция с хлорид – ионами.
Pb2+ + 2 Сl- = PbCl2 ↓ (белый)
2). Реакция с йодид – ионами (фармакопейная).
Pb2+ + 2 I- = PbI2 ↓ (желтый)
3). Реакция с хромат - и дихромат – ионами.
Pb2+ + CrO42- = PbCrO4 ↓ (желтый)
2 Pb2+ + Cr2O72- + 2 СН3СОО- + НОН = 2 PbCrO4 ↓ + 2 СН3СООН
4). Реакция с сульфат – ионами.
Pb2+ + SO42- = PbSO4 ↓ (белый)
5). Реакция с сульфид – ионами (фармакопейная).
Pb2+ + S2- = PbS ↓ (черный)
6). Реакция с родизонатом натрия Na2C6O6.
Катионы свинца образуют с родизонатом Na окрашенный комплекс синего цвета (Pb3(C6O6)2(OH)2), который в слабо кислой среде (рН = 2,8) изменяет окраску на красную.
3. Аналитические реакции катионов III аналитической группы по кислотно-основной классификации: Ca2+, Sr2+, Ba2+.
Групповой реагент - H2SO4.
3.1. Качественные реакции катионов Са2+
1). Реакция с сульфат – ионами.
Са2+ + SO42- + 2 H2O → CaSO4 * 2 H2O ↓ /белый/
а) Растворяется в насыщенном водном растворе сульфата аммония с образованием комплекса (NH4)2[Ca(SO4)2], что позволяет отделить Ca2+ от Sr2+ и Ва2+;
CaSO4 + (NH4)2SO4 → (NH4)2[Ca(SO4)2]
б) В растворе соды Na2CO3 белый осадок сульфата кальция переходит в белый осадок карбоната кальция, который в дальнейшем растворяется в кислотах.
2). Реакция с оксалатом аммония (фармакопейная).
Са2+ + С2О42- → СаС2О4 ↓ (белый кристаллический)
· Осадок нерастворим в растворе аммиака, но растворяется в разбавленных минеральных кислотах с образованием щавелевой кислоты.
3). Реакция с углекислым натрием (Na2CO3).
Са2+ + Na2CO3 = CaCO3 ↓ (белый) + 2Na+
4). Реакция с гексацианоферратом (II) калия.
Ca2+ + 2 NH4+ + [Fe (CN)6]4- = (NH4)2Ca[Fe(CN)6]↓
Признаки реакции: Выпадает белый кристаллический осадок смешанного гексацианоферрата (II) аммония и кальция, который не растворяется в уксусной кислоте.
5).Реакция с гидрофосфатом натрия (Na2HPO4).
Са2+ + НРО42- = СаНРО4 ↓ (белый).
6). Реакция с родизонатом натрия.
Na2C6O6 + 2 Ca2+ + 2 OH- → Ca2С6O6(OH)2 + 2 Na+.
Признаки реакции: Выпадает фиолетовый осадок.
7). Окрашивание пламени (фармакопейный тест).
Соли и другие соединения кальция окрашивают бесцветное пламя горелки в кирпично-красный цвет.
3.2. Качественные реакции катионов Sr2+
1). Реакция с серной кислотой и растворимыми сульфатами.
Sr2+ + SO42- = SrSO4 ↓ (белый кристаллический)
2. Реакция с карбонат - ионами.
Sr2+ + CO32- = SrCO3 ↓ (белый кристаллический)
· Осадок растворим в кислотах.
3. Реакция с оксалатом аммония.
Sr2+ + C2O42- = SrC2O4 ↓ (белый)
· Осадок частично растворяется в уксусной кислоте.
4. Реакция с гидрофосфатом натрия (Na2HРО4).
Sr2+ + HPO42- = SrHPO4 ↓ (белый)
· Осадок растворяется в минеральных и уксусной кислотах.
5. Реакция с родизонатом натрия.
Sr2+ + Na2C6O6 = SrC6O6 + 2 Na+
Признаки реакции: Наблюдается образование красно-бурого пятна на фильтровальной бумаге, которое исчезает при нанесении на пятно раствора HCl.
6. Окрашивание пламени газовой горелки.
Соли стронция при внесении в бесцветное пламя горелки окрашивают пламя в карминово-красный цвет.
3.3. Качественные реакции катионов Ва2+
1). Реакция с серной кислотой и растворимыми сульфатами.
Ва2+ + SO42- = BaSO4 ↓ (белый мелкокристаллический)
· Осадок нерастворим в щелочах и кислотах, за исключением концентрированной H2SO4, в которой он заметно растворяется с образованием гидросульфата бария:
BaSO4 + H2SO4 → Ba(HSO4)2.
· При нагревании с раствором карбонатов (Na2CO3) сульфат бария превращается в мало растворимый в Н2О карбонат бария ВаСО3, который растворяется в кислотах.
2). Реакции с углекислым натрием, гидрофосфатом натрия и оксалатом аммония.
Признаки реакции: Выпадают белые осадки, растворимые в соляной, азотной и уксусной кислотах (ВаС2О4 с уксусной кислотой при нагревании).
3). Реакция с родизонатом натрия.
Ва2+ + Na2C6O6 = BaC6O6 + 2 Na+
Признаки реакции: Наблюдается образование красно-бурого пятна на фильтровальной бумаге, которое краснеет в следствии перехода родизоната в гидрородизонат при нанесении на пятно раствора HCl.
4). Реакция с хроматом и дихроматом калия.
Ва2+ + СrO42- = BaCrO4 ↓ (желтый)
2 Ba2+ + Cr2O72- + 2 CH3COO- + HOH = 2 BaCrO4 + 2 CH3COOH
· Осадок хромата бария растворяется в сильных кислотах (кроме H2SO4), но не растворяется в уксусной кислоте.
· При реакции с дихромат – ионами в присутствии ацетат – ионов катионы бария осаждаются практически полностью (количественно), так как хромат бария менее растворим в воде, чем дихромат бария.
5. Окрашивание пламени горелки.
Соли и другие соединения бария окрашивают бесцветное пламя горелки в желто-зеленый цвет.
4. Аналитические реакции катионов IV аналитической группы по кислотно-основной классификации: Zn2+, Al3+, Sn2+, Sn4+, As3+, As5+, Cr3+.
Групповой реагент – гидроксид натрия или калия в присутствии Н2О2
4.1. Аналитические реакции катиона цинка Zn2+.
1. Реакция с щелочами.
Zn2+ + 2 OH- → Zn(OH)2 ↓ (белый)
Zn(OH)2 + 2 OH- → [Zn(OH)4]2- (бесцветный)
2. Реакция с раствором аммиака.
Zn2+ + 2 NH3*H2O → Zn(OH)2 ↓ (белый) + 2 NH4+
Zn(OH)2 + 4 NH3 → [Zn(NH3)4] (OH)2 (бесцветный)
3. Реакция с сульфид – ионами (фармакопейная).
Реакцию проводят в нейтральной, слабокислой или слабощелочной среде (2≤ рН ≤ 9).
Zn2+ + S2- → ZnS ↓ (белый)
· Осадок не растворяется в уксусной кислоте, но растворяется в растворах HCl и других минеральных кислот.
4. Реакция с гексацианоферратом (II) калия (фармакопейная).
Реакцию проводят в нейтральной или слабокислой среде, а для ускорения – при нагревании.
2 К+ + 3 Zn2+ +2 [Fe(CN)6]4- → K2Zn3 [Fe(CN)6]2↓ (белый)
· Осадок нерастворим в разбавленной HCl; растворяется в щелочах, поэтому реакцию нельзя проводить в щелочной среде.
5. Реакция с дитизоном (дифенилтиокарбазоном).
В растворах дитизона устанавливается таутомерное равновесие между тионной и тиольной формами:
N = N – C6H5 N = N – C6H5
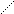
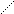
 S = C <=> НS
S = C <=> НS


NH – NH – C6H5 N – NH – C6H5
Тионная форма тиольная форма
Тиольная форма представляет собой слабую двухосновную кислоту, способную отщеплять ионы водорода, в первую очередь – от группы SH, и образовывать комплексы с ионами металлов – комплексообразователей. Если отщепляется только один протон, то в результате реакции с катионами цинка возникает внутрикомплексное соединение, содержащее два дитизонатных аниона:
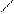 N = N - C6H5 C6H5 – HN – N = C – N = N - C6H5
N = N - C6H5 C6H5 – HN – N = C – N = N - C6H5
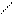


 2HS – C + Zn2+ ↔ ↓
2HS – C + Zn2+ ↔ ↓
N – NH - C6H5 S - Zn - S +2 Н+
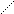 ↓
↓
C6H5 – N = N – C = N – NH - C6H5 (красный)
Наличие щелочи способствует смещению равновесия вправо вследствие связывания выделяющихся ионов водорода в молекуле воды.
Признаки реакции: Пробирку встряхивают несколько раз. После расслоения смеси хлороформный слой окрашивается в красный цвет.
6. Реакция образования «зелени Ринмана».
Zn(NO3)2 + Co(NO3)2 → CoZnO2 (зеленый) + 4 NO2 +O2.
«Зелень Ринмана» - смешанный оксид кобальта и цинка CoZnO2 зеленого цвета.
Признаки реакции: Горячим раствором смачивают полоску фильтровальной бумаги, высушивают ее и озоляют в фарфоровом тигле на газовой горелке. Образуется зола зеленого цвета.
Катионы Zn2+ при взаимодействии с различными другими реактивами образуют осадки: с Na2HPO4 – белый Zn3(PO4)2 (растворяется в кислотах и в аммиаке); с K2CrO4 – желтый ZnCrO4 (растворяется в кислотах и щелочах); с CoCl2 и (NH4)2[Hg (SCN)4] – голубой ZnCo[Hg (SCN)4]; а также с различными органическими реагентами.
4.2. Аналитические реакции катиона алюминия Al3+.
1. Реакция с щелочами.
Al3+ + 3 OH- → Al(OH)3 ↓ (белый)
Al(OH)3 + 3 OH- → [Al(OH)6]3-
После растворения гидроксида алюминия и образования гидроксокомплексов алюминия к раствору прибавляют несколько кристаллов соли аммония (NH4Cl). Смесь нагревают. Гидроксокомплексы разрушаются и снова выпадает осадок Al(OH)3:
[Al(OH)6]3- + 3 NH4+ → Al(OH)3 + 3 NH3 + 3 H2O
Наиболее полное осаждение гидроксида алюминия происходит при рН~ 5-6.
· Осадок Al(OH)3 растворяется в кислотах, но не растворяется в аммиаке
2. Реакция с аммиаком.
Al3+ + 3 NH3*H2O → Al(OH)3 ↓ (белый аморфный) + 3 NH4+
В избытке раствора аммиака осадок не растворяется, в отличие от действия щелочей.
3. Реакция с нитратом кобальта – образование «тенаровой сини» (фармакопейная).
«Тенаровая синь» - смешанный оксид алюминия и кобальта (алюминат кобальта) Со(АlO2)2 синего цвета.
2 Al2(SO4)3 + 2 Co(NO3)2 → 2 Cо(AlO2)2 + 4 NO2 + 6 SO3 + O2.
Признаки реакции: Полоску фильтровальной бумаги смачивают вначале 1-2 каплями раствора сульфата алюминия Al2(SO4)3, а затем 1-2 каплями разбавленного раствора нитрата кобальта. Бумагу высушивают, помещают в фарфоровый тигель и озоляют на газовой горелке. Получают золу синего цвета – «тенаровую синь».
4. Реакция с алюминоном.
Катионы Al3+ при взаимодействии с алюминоном – аммонийной солью ауринтрикарбоновой кислоты (для краткости NH4L) образует в уксуснокис-лой или аммиачной среде комплекс красного цвета (по-видимому, состава Al(OH)2L. Точное строение комплекса неизвестно.
5. Реакция с ализарином (1,2 – диоксиантрахинон).
Катионы Al3+ с ализарином и его производными в аммиачной среде образует комплексы ярко красного цвета называемые «алюминиевыми лаками».
 2015-05-06
2015-05-06 16008
16008