При изобарном процессе передаваемое газу количеству теплоты идет на изменение его внутренней энергии и на совершение работы при постоянном давлении (p=const). Q=U+A
24. Термодинамическая шкала температур. Абсолютный нуль.
Из повседневного опыта известно, что тела бывают горячими и холодными, то есть по разному нагретыми. Для количественного описания такого различия, то есть для описания степени нагретости в физике ввели понятие температуры. При соприкосновении по разному нагретых тел более холодное начинает нагреваться, а более горячее – охлаждаться. Такой процесс называют теплопередачей (обмен тепла). В этом процессе температуры тел становятся одинаковыми. В конце концов наступает момент, когда все соприкасающиеся тела имеют одинаковую температуру. Такое состояние называют тепловым равновесием. В этом состоянии не происходит уже никаких изменений температуры.
Термодинамическое (тепловое) равновесия – состояние, в котором не происходит никаких изменений термодинамических параметров – температуры, давления, плотности и т.д.
Температура – физический параметр, одинаковый во всех частях системы тел, находящихся в состоянии теплового равновесия.
Для измерения температуры используются различные шкалы температур.
Шкала Цельсия:
В качестве нуля температурной шкалы – 0 0С- выбрана точка плавления льда, а точке кипения воды приписано значение в 100 0С. В качестве единицы измерения – градус Цельсия – принята 1/100 часть интервала между этими точками.
Шкала Кельвина (абсолютная шкала температур):
В качестве нуля принят так называемый абсолютный ноль температуры, то есть температура ниже которой невозможно ничего охладить. Единица измерения – градус Кельвина- выбран равным градусу Цельсия. Так как точка таяния льда имеет температуру 273,15 К, то связь между шкалой Цельсия и шкалой Кельвина следующая:
Т (К) = Т (0С) = +273,15
Абсолютный ноль температуры также невозможно достичь, как и отрицательные температуры. Это утверждение представляет собой –третий закон термодинамики. В МКТ температура характеризует величину средней энергии хаотичного движения молекул – у более теплого тела молекулы движутся быстрее.
25. Первое начало термодинамики (первый закон термодинамики).
Энергия, полученная системой путем теплообмена, расходуется на изменение ее внутренней энергии и на работу против внешних сил.
Q=ΔU-A
Тепло, переданное газу, расходуется на – изменение его внутренней энергии (нагрев), совершение газом работы (например, при его расширении).
Изменение внутренней энергии системы равно сумме работы внешних сил и количеству теплоты, переданного системе:
ΔU= A+Q
26. Внутренняя энергия идеального газа (одноатомного, двух атомного, много атомного).
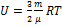 (Одноатомный газ)
(Одноатомный газ)
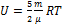 (двухатомный газ)
(двухатомный газ)
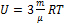 (многоатомный газ)
(многоатомный газ)
Где 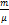 - кол – во вещества, -газовая постоянная (8,31 Дж/моль), Т – термодинамическая постаянная.
- кол – во вещества, -газовая постоянная (8,31 Дж/моль), Т – термодинамическая постаянная.
27. Вывод уравнения объединенного газового закона
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа.
Уравнение Клапейрона-Менделеева показывает, что для данной массы газа возможно одновременно изменение трех параметров, характеризующих состояние идеального газа.
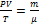 R, где R — универсальная газовая постоянная, R = 8,31 Дж/моль. P-давление(паскаль), V-объем(м3), T-термодинамическая температура (к),
R, где R — универсальная газовая постоянная, R = 8,31 Дж/моль. P-давление(паскаль), V-объем(м3), T-термодинамическая температура (к), 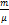 – количество вещества υ. дописать
– количество вещества υ. дописать
28. Закон Шарля.
 2015-04-20
2015-04-20 5380
5380
