Давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. Это утверждение можно считать другой формулировкой основного уравнения молекулярно-кинетической теории идеального газа.
21. Температура как мера средней кинетической энергии хаотического движения молекул.
Для нахождения микроскопических параметров газа нужны измерения еще какой-то физической величины, связанной со средней кинетической энергией молекул. Такой величиной в физике является температура.
Бывают тела горячие и холодные. При контакте двух тел, из которых одно мы воспринимаем как горячее, а другое — как холодное, происходят изменения физических параметров как первого, так и второго тела. Через некоторое время после установления контакта между телами изменения макроскопических параметров тел прекращаются. Такое состояние тел называется тепловым равновесием. Физический параметр, одинаковый во всех частях системы тел, находящихся в состоянии теплового равновесия, называется температурой тела.Средняя кинетическая энергия молекул любых газов, находящихся в тепловом равновесии, одинакова.
Шкала измерения температуры в соответствии с уравнением называется абсолютной шкалой, ее называют шкалой Кельвина.1 К = 1 °С
Температура, при которой давление идеального газа при постоянном объеме должно быть равно нулю, называется абсолютным нулем температуры.
Температура — мера средней кинетической энергии молекул.Средняя кинетическая энергия хаотического движения молекул газа пропорциональна абсолютной температуре. P=KTh0. Чем выше температура, тем быстрее движутся молекулы, т.е. больше их кинетическая энергия. При одинаковых значениях температуры и концентрации молекул давление любых газов одинаково, независимо от того, из каких молекул они состоят.
22. Уравнение Клапейрона-Менделеева.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа.
Уравнение Клапейрона-Менделеева показывает, что для данной массы газа возможно одновременно изменение трех параметров, характеризующих состояние идеального газа.
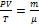 R, где R — универсальная газовая постоянная, R = 8,31 Дж/моль.P-давление(паскаль), V-объем(м3), T-термодинамическая температура (к),
R, где R — универсальная газовая постоянная, R = 8,31 Дж/моль.P-давление(паскаль), V-объем(м3), T-термодинамическая температура (к), 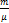 – количество вещества υ
– количество вещества υ
23. Изопроцессы и их графики.
Изопроцессы - это процессы, протекающие при неизменном значении одного из макроскопических параметров (р, V, Т).
Закон начальной термодинамике. U =A+Q, гдеU- внутренняя энергия газа, A-работа газа, Q-тепло.
 2015-04-20
2015-04-20 704
704








