Во второй половине XIX столетия ученые поняли, что атомы различных химических элементов излучают свет строго определенных частот и длин волны, и такое излучение имеет линейчатый спектр, благодаря чему их свет имеет характерную окраску.
С развитием спектроскопии стало ясно, что атом любого химического элемента имеет свой набор спектральных линий, по которым его можно вычислить даже в составе далеких звезд. В 1885 году швейцарский математик Иоганн Бальмер сделал первый шаг в направлении расшифровки закономерности расположения спектральных линий в излучении атома водорода, эмпирически выведя формулу, описывающую длины волн в видимой части спектра атома водорода (так называемая спектральная линия Бальмера). Водород — самый простой по структуре атом, и поэтому математическое описание расположения линий его спектра было получено раньше всего. Четыре года спустя шведский физик Йоханнес Ридберг обобщил формулу Бальмера, распространив ее на все участки спектра электромагнитного излучения атома водорода, включая ультрафиолетовую и инфракрасную области. Согласно формуле Ридберга, длина световой волны λ, которую излучает атом водорода, определяется формулой 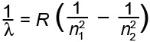 , где R — постоянная Ридберга (R = 3,29·1015 Гц.), а n1 и n2 — натуральные числа (при этом n1 < n2). В частности, при n1 = 2 и n2 = 3, 4, 5,... наблюдаются линии видимой части спектра излучения водорода (n2 = 3 — красная линия; n2 = 4 — зеленая; n2 = 5 — голубая; n2 = 6 — синяя) — это так называемая серия Бальмера. При n1 = 1 водород дает спектральные линии в ультрафиолетовом диапазоне частот (серия Лаймана); при n2 = 3, 4, 5,... излучение переходит в инфракрасную часть электромагнитного спектра.
, где R — постоянная Ридберга (R = 3,29·1015 Гц.), а n1 и n2 — натуральные числа (при этом n1 < n2). В частности, при n1 = 2 и n2 = 3, 4, 5,... наблюдаются линии видимой части спектра излучения водорода (n2 = 3 — красная линия; n2 = 4 — зеленая; n2 = 5 — голубая; n2 = 6 — синяя) — это так называемая серия Бальмера. При n1 = 1 водород дает спектральные линии в ультрафиолетовом диапазоне частот (серия Лаймана); при n2 = 3, 4, 5,... излучение переходит в инфракрасную часть электромагнитного спектра.
 2015-04-20
2015-04-20 470
470








