1 Соли, кислоты и основания при растворении в воде и некоторых других полярных растворителях диссоциируют на ионы.
2 Ионы существуют в растворе независимо от того, проходит через раствор электрический ток или нет. Вследствие этого число независимо движущихся частиц растворенного вещества больше, чем при отсутствии диссоциации, и коллигативные свойства электролитов возрастают в i раз.
3 Процесс диссоциации описывается законом действующих масс (протекает обратимо). При уменьшении концентрации диссоциация становится практически полной
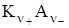 ↔ ν+ Kz+ + ν – Az-
↔ ν+ Kz+ + ν – Az-
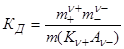
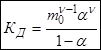
В частном случае при ν+=ν–=1
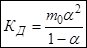 (*)
(*)
Здесь ν=ν++ν– - общее число ионов, образующихся при диссоциации одной молекулы,
m+, m– - моляльности ионов,
m(Kν+Aν–) – моляльность недиссоциированных молекул,
m0 – моляльность раствора при расчете на полностью недиссоциированное вещество,
α – степень диссоциации – доля диссоциированных молекул,
КД – практическая константа диссоциации.
4 Коэффициент Вант-Гоффа i – изотонический коэффициент – связан со степенью электролитической диссоциации. i – среднее суммарное число частиц (ионов и молекул), образующихся при диссоциации одной молекулы
i = ν + α + ν- α + (1-α) = 1 + (ν++ν–-1)α = 1 + (ν – 1)α i = 1+(ν-1)α
По мере увеличения разведения коэффициент Вант-Гоффа приближается к простому целому числу (2,3,4 – в зависимости от числа ионов, образующихся при растворении молекул вещества):
NaCl = Na+ + Cl- i→2
K2SO4 = 2K+ + SO 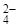 i→3
i→3
AlCl3 = Al3+ + 3Cl- i→4
K4[Fe(CN)6] = 4K+ + [Fe(CN)6]2- i→5
 2015-04-20
2015-04-20 3188
3188








