Диссоциация воды - разложение воды на составляющие химические элементы, иногда происходящая с созданием новых элементов, изначально в разлагаемом растворе не содержащихся, или содержащихся до начала разложения в меньшем количестве, чем после завершения процесса диссоциации.
Диссоциация воды является эндотермической реакцией (см.эндотермическая реакция), т.е. идущей с поглощением теплоты из окружающей среды.
Известные способы диссоциации воды:
1. Электролиз водных растворов-электролитов. - наименее эффективный из известных на сегодня способов разложения воды, так как в этом случае энергия затрачивается, в основном, на нагрев проводника - электролита, настолько, что диссциируемый раствор не только не охлаждается, но, напротив, подвергается значительному нагреву. В промышленности XX века именно этот способ получил наибольшее распространение, в силу того, что обеспечивает спрос и позволяет поддерживать высокие цены на такой товар, как невосполнимые энергоресурсы, из которых получают электричество, таких как нефть, газ, каменный угль и т.п.
2.Модель процесса разложения воды в центробежном поле Например, во вращающийся барабан заливается подогретый электролит, в котором при вращении в результате начинающегося электрохимического процесса происходит разложение воды на водород и кислород. Этот процесс разлагает воду с помощью кинетической энергии внешнего источника и тепловой энергии подогретого электролита. На основе данного процесса имеется ряд патентов, один из которых (RU 98/00190 (22.06.1998)) авторы - Кудымов Г.И и Студенников В.В. позиционируют, в том числе, и как и тепловой насос, поглощающий теплоту окружающей среды, таким образом, получение водородно-кислородной смеси здесь производится, в значительной мере за счет энергии окружающей среды или за счет обычно безвозвратно теряемого тепла, например выхлопных газов двигателей внутреннего сгорания.
Водоро́дный показа́тель, pH (произносится «пэ аш», английское произношение англ. pH — piː'eɪtʃ «Пи эйч») — мера активности (в очень разбавленных растворах она эквивалентна концентрации)ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:
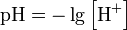
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH−] говорят, что раствор является кислым, а при [OH−] > [H+] — щелочным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который собственно и является водородным показателем — pH.
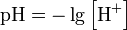
POH
Несколько меньшее распространение получила обратная pH величина — показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH−:
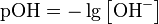
как в любом водном растворе при 22 °C 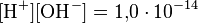 , очевидно, что при этой температуре:
, очевидно, что при этой температуре:
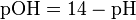
 2015-04-20
2015-04-20 2170
2170








