План
- Классификация органических реакций по степени сложности.
- Элементарные реакции, их классификация.
- Классификация реагентов.
- Типы интермедиатов.
- Понятие о скорость-определяющей стадии и переходном состоянии реакции.
Органические реакции характеризуются различными сторонами. Соответственно, эти реакции могут быть по-разному классифицированы в зависимости от того, какая из сторон взята за основу.
В зависимости от степени сложности органические (да и другие) реакции могут быть подразделены на простые и сложные.
Простыми называются реакции, в которых не образуются в измеримых количествах какие-либо вещества, кроме тех, которые фигурируют в стехиометрическом уравнении:
n AA + nBB + ¼ Ûn XX + nYY ¼ (1)
Простые реакции могут быть обратимыми и необратимыми.
Сложные реакции представляют собой совокупность простых реакций. Очевидно, что соотношение между реагентами и продуктами каждой простой реакции, входящей в сложную, не подчиняются ее стехиометрическому уравнению, поскольку продукты или реагенты этой реакции одновременно вовлекаются в другие простые реакции.
Иллюстрацией сложной реакции является схема:
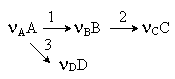
в которой реакции 1 и 2 являются последовательными, а реакции 1 и 3 – параллельными. Можно видеть, что последовательными реакциями являются такие, в которых продукт одной реакции является реагентом для следующей за ней другой реакции. В то же время параллельные – это такие реакции, в которых участвует один и тот же реагент. Последовательно-параллельные реакции имеют признаки обеих реакций:
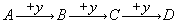
В свою очередь простые реакции подразделяются на элементарные и неэлементарные.Элементарные реакции протекают через одну микростадию и характеризуются единственным переходным состоянием. Неэлементарные реакции протекают через ряд химических микростадий, в которых участвуют промежуточные комплексы, ионы и другие частицы (интермедиаты), не фигурирующие в стехиометрическом уравнении, например
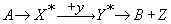
Концентрация интермедиатов X* и Y* пренебрежимо мала и реакции с достаточной степенью точности описываются стехиометрическим уравнением
A + Y ® B + Z
Каждая микростадия, входящая а неэлементарную реакцию, является элементарной.
Совокупность элементарных стадий, через которые протекает реакция, включая детали каждой из этих стадий (природа интермедиатов и характер разрыва и образования химических связей) составляет механизм этой реакции. В зависимости от числа частиц (молекул, комплексов, ионов, других интермедиатов), участвующих в элементарных реакциях, различают мономолекулярные и бимолекулярные реакции. К мономолекулярным относятся элементарные реакции изомеризации (перегруппировки) и расщепления. При гомолитическом расщеплении химической связи ее пара электронов претерпевает симметричный распад, в результате которого к каждой из образующихся частиц отходит по одному электрону, например:
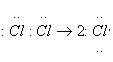
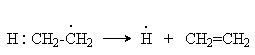
При гетеролитическом расщеплении разрыв связи в реагенте происходит несимметрично с отходом пары электронов этой связи к одному из образующихся фрагментов:
R:Cl ® RÅ +:Cl-
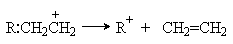
Бимолекулярные элементарные реакции классифицируют по типу разрыва старой и образования новой химической связи, а также по природе атакующего реагента. В зависимости от последнего они бывают нуклеофильными (N), электрофильными (Е) и радикальными (R). Кроме этого, каждая из них может быть реакцией замещения (S) или присоединения (Ad).
В нуклеофильных реакциях атакующий реагент (нуклеофил) имеет на одном из своих атомов свободную пару электронов и является нейтральной молекулой
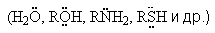 или отрицательно заряженным ионом
или отрицательно заряженным ионом
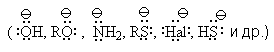 Этот реагент атакует в субстрате атом с наименьшей электронной плотностью (т.е. с частичным положительным зарядом). При этом новая связь образуется за счет электронной пары нуклеофила, а старая претерпевает несимметричный (гетеролитический) разрыв с отходом ее электронной пары к другому атому:
Этот реагент атакует в субстрате атом с наименьшей электронной плотностью (т.е. с частичным положительным зарядом). При этом новая связь образуется за счет электронной пары нуклеофила, а старая претерпевает несимметричный (гетеролитический) разрыв с отходом ее электронной пары к другому атому:
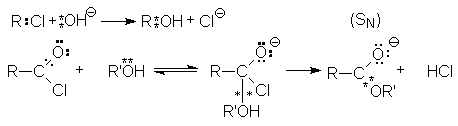
В электрофильных реакциях атакующий реагент (электрофил) имеет у одного из своих атомов незаполненную орбиталь и является нейтральной молекулой (Cl2, SO3, BH3 и др.) или положительно заряженным ионом  Он атакует в органическом субстрате атом с наибольшей электронной плотностью, причем старая связь претерпевает гетеролитический распад с образованием новой связи между атакуемым атомом и электрофилом за счет пары электронов старой связи:
Он атакует в органическом субстрате атом с наибольшей электронной плотностью, причем старая связь претерпевает гетеролитический распад с образованием новой связи между атакуемым атомом и электрофилом за счет пары электронов старой связи:
RÅ + (CH3)3C:H ® R:H ® (CH3)3CÅ(SE)
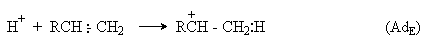
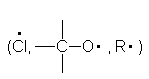
В радикальных реакциях атакующий реагент имеет на одном из атомов неспаренный электрон и является свободным атомом или радикалом
При реализации радикальных реакций рвущаяся связь органической молекулы претерпевает симметричный (гомолитический) разрыв, а новая связь образуется за счет неспаренного электрона свободного радикала и одного из электронов прежней связи. При этом второй электрон прежней связи дает начало новому свободному радикалу:
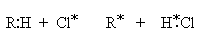
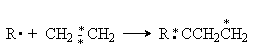
Из рассмотренных примеров можно видеть, что по типу разрыва прежней связи бимолекулярные реакции можно подразделить на гомолитические (радикальные) и гетеролитические или ионные (нуклеофильные и электрофильные).
Имеется особый класс органический реакций, в которых происходит одновременный разрыв и образование нескольких связей за счет синхронного перемещения электронов в циклическом комплексе. В этом случае говорить о гомолитическом или гетеролитическом характере реакций не имеет смысла, и такие процессы называются согласованными или многоцентровыми. Примером такого согласованного процесса является реакция Дильса-Альдера.
Взаимодействующие в органических реакциях вещества подразделяются на реагенты и субстраты. Реагент – это субъект атаки, молекулы которого либо сами выступают в роли атакующих частиц, либо при реализации механизма реакции продуцируют атакующие частицы. Признаком частицы–реагента является наличие в ней электрофильного, нуклеофильного или радикального характера. Субстрат – объект атаки. Так, при реакции брома с этиленом бром рассматривается как реагент, а этилен – как субстрат, поскольку молекула брома имеет вакантную разрыхляющую орбиталь, обладающую низкой энергией и поэтому является электрофильным агентом. В реакции метана с хлором реагентом является хлор, а субстратом метан, поскольку молекулярный хлор является источником хлор-радикалов, выступающих в роли атакующих частиц по отношению к метану.
В свою очередь в элементарных бимолекулярных реакциях различают пару “реагент-субстрат”, причем в качестве реагента выступает нуклеофильная, электрофильная или радикальная частица, а в роли субстрата – атакуемая молекула.
 2015-04-23
2015-04-23 2352
2352
