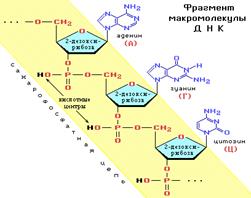
Дезоксирибонуклеиновая кислота (ДНК) — макромолекула, обеспечивающая хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. Основная роль ДНК в клетках — долговременное хранение информации о структуре РНК и белков. В клетках эукариотов (например, животных или растений) ДНК находится в ядре клетки в составе хромосом, а также в некоторых клеточных органоидах (митохондриях и пластидах). С химической точки зрения ДНК — это длинная полимерная молекула, состоящая из повторяющихся блоков — нуклеотидов. Каждый нуклеотид состоит из азотистого основания, сахара (дезоксирибозы) и фосфатной группы. Связи между нуклеотидами в цепи образуются за счёт дезоксирибозы и фосфатной группы. В подавляющем большинстве случаев (кроме некоторых вирусов, содержащих одноцепочечную ДНК) макромолекула ДНК состоит из двух цепей, ориентированных азотистыми основаниями друг к другу. Эта двухцепочечная молекула спирализована. В целом структура молекулы ДНК получила название «двойной спирали». В ДНК встречается четыре вида азотистых оснований (аденин, гуанин, тимин и цитозин). Азотистые основания одной из цепей соединены с азотистыми основаниями другой цепи водородными связями согласно принципу комплементарности: аденин соединяется только с тимином, гуанин — только с цитозином. Нуклеотиды соединены между собой ковалентно в длинные полинуклеотидные цепи. Эти цепи в подавляющем большинстве случаев (кроме некоторых вирусов, обладающих одноцепочечными ДНК-геномами) попарно объединяются при помощи водородных связей во вторичную структуру, получившую название двойной спирали.Остов каждой из цепей состоит из чередующихся фосфатов и сахаров.Внутри одной цепи ДНК соседние нуклеотиды соединены фосфодиэфирными связями, которые формируются в результате взаимодействия между 3'-гидроксильной (3'—ОН) группой молекулы дезоксирибозы одного нукдеотида и 5'-фосфатной группой (5'—РО3) другого. Асимметричные концы цепи ДНК называются 3' (три прим) и 5' (пять прим). Полярность цепи играет важную роль при синтезе ДНК (удлинение цепи возможно только путём присоединения новых нуклеотидов к свободному 3'-концу). Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, наиболее важными из которых являются информационные, или матричные (мРНК), рибосомальные (рРНК) и транспортные (тРНК). эти типы РНК синтезируются на матрице ДНК за счёт копирования последовательности ДНК в последовательность РНК, синтезируемой в процессе транскрипции, и принимают участие в биосинтезе белков (процессе трансляции). Помимо кодирующих последовательностей, ДНК клеток содержит последовательности, выполняющие регуляторные и структурные функции
Рибонуклеиновая кислота (РНК) — одна из трёх основных макромолекул (две другие — ДНК и белки), которые содержатся в клетках всех живых организмов.Так же, как ДНК (дезоксирибонуклеиновая кислота), РНК состоит из длинной цепи, в которой каждое звено называется нуклеотидом. Каждый нуклеотид состоит из азотистого основания, сахара рибозы и фосфатной группы. Последовательность нуклеотидов позволяет РНК кодировать генетическую информацию. Все клеточные организмы используют РНК (мРНК) для программирования синтеза белков.Клеточные РНК образуются в ходе процесса, называемого транскрипцией, то есть синтеза РНК на матрице ДНК, осуществляемого специальными ферментами — РНК-полимеразами. Затем матричные РНК (мРНК) принимают участие в процессе, называемом трансляцией. Трансляция — это синтез белка на матрице мРНК при участии рибосом. Другие РНК после транскрипции подвергаются химическим модификациям, и после образования вторичной и третичной структур выполняют функции, зависящие от типа РНК. Между ДНК и РНК есть три основных отличия:
ДНК содержит сахар дезоксирибозу, РНК — рибозу, у которой есть дополнительная, по сравнению с дезоксирибозой, гидроксильная группа. Эта группа увеличивает вероятность гидролиза молекулы, то есть уменьшает стабильность молекулы РНК.
Нуклеотид, комплементарный аденину, в РНК не тимин, как в ДНК, а урацил — неметилированная форма тимина.
ДНК существует в форме двойной спирали, состоящей из двух отдельных молекул. Молекулы РНК, в среднем, гораздо короче и преимущественно одноцепочечные.
Вторичная структура ДНК представляет собой две параллельные неразветвленные полинуклеотидные цепи, закрученные вокруг общей оси в двойную спираль. Такая пространственная структура удерживается множеством водородных связей, образуемых азотистыми основаниями, направленными внутрь спирали.Водородные связи возникают между пуриновым основанием одной цепи и пиримидиновым основанием другой цепи. Эти основания составляют комплементарные пары (от лат. complementum - дополнение).Образование водородных связей между комплементарными парами оснований обусловлено их пространственным соответствием. Пиримидиновое основание комплементарно пуриновому основанию. ТИМИН (Т) комплементарен АДЕНИНУ (А),ЦИТОЗИН (Ц) комплементарен ГУАНИНУ (Г).Комплементарность полинуклеотидных цепей служит химической основой главной функции ДНК – хранения и передачи наследственных признаков. Вторичная структура РНК. В отличие от ДНК, молекулы РНК состоят из одной полинуклеотидной цепи и не имеют строго определенной пространственной формы.).
21. Генетический код и его свойства. Строение, виды и биологическая роль RNA.
1. Понятие генетического кода
Генетический код - свойственная живым организмам единая система записи наследственной информации в молекулах нуклеиновых кислот в виде последовательности нуклеотидов. Каждый нуклеотид обозначается заглавной буквой, с которой начинается название азотистого основания, входящего в его состав: - А (A) аденин; - Г (G) гуанин; - Ц (C) цитозин; - Т (T) тимин (в ДНК) или У (U) урацил (в мРНК).
 2. Свойства генетического кода.
2. Свойства генетического кода.
Триплетность — значащей единицей кода является сочетание трёх нуклеотидов (триплет, или кодон). Непрерывность — между триплетами нет знаков препинания, то есть информация считывается непрерывно. Неперекрываемость — один и тот же нуклеотид не может входить одновременно в состав двух или более триплетов (не соблюдается для некоторых перекрывающихся генов вирусов, митохондрий и бактерий, которые кодируют несколько белков, считывающихся со сдвигом рамки). Однозначность (специфичность) — пределённый кодон соответствует только одной аминокислоте. Вырожденность (избыточность) — одной и той же аминокислоте может соответствовать несколько кодонов. Универсальность — генетический код работает одинаково в организмах разного уровня сложности — от вирусов до человека. Рибонуклеиновая кислота (РНК) — одна из трёх основных макромолекул (две другие — ДНК и белки), которые содержатся в клетках всех живых организмов. Так же, как ДНК (дезоксирибонуклеиновая кислота), РНК состоит из длинной цепи, в которой каждое звено называется нуклеотидом. Каждый нуклеотид состоит из азотистого основания, сахара рибозы и фосфатной группы. Последовательность нуклеотидов позволяет РНК кодировать генетическую информацию. Все клеточные организмы используют РНК (мРНК) для программирования синтеза белков.
СТРОЕНИЕ Нуклеотиды РНК состоят из сахара — рибозы, к которой в положении 1' присоединено одно из оснований: аденин, гуанин, цитозин или урацил. Фосфатная группа соединяет рибозы в цепочку, образуя связи с 3' атомом углерода одной рибозы и в 5' положении другой. Типы РНК. Матричная рибонуклеиновая кислота (мРНК, синоним - информационная РНК, иРНК) - РНК, отвечающая за перенос информации о первичной структуре белков от ДНК к местам синтеза белков. мРНК синтезируется на основе ДНК в ходе транскрипции, после чего, в свою очередь, используется при трансляции как матрица для синтеза белков. Тем самым мРНК играет важную роль в «проявлении» (экспрессии) генов.
Транспортные (тРНК) - малые, состоящие из примерно 80 нуклеотидов, молекулы с консервативной третичной структурой. Они переносят специфические аминокислоты к месту синтеза пептидной связи в рибосоме. Каждая тРНК содержит участок для присоединения аминокислоты и антикодон для узнавания и присоединения к кодону мРНК. Антикодон образует водородные связи с кодоном, что помещает тРНК в положение, способствующее образованию пептидной связи между последней аминокислотой образованного пептида и аминокислотой, присоединенной к тРНК.
Рибосомальные РНК (рРНК) - каталитическая составляющая рибосом. Эукариотические рибосомы содержат четыре типа молекул рРНК: 18S, 5.8S, 28S и 5S. Три из четырех типов рРНК синтезируются на полисомах. В цитоплазме рибосомальные РНК соединяются с рибосомальными белками и формируют нуклеопротеины, называемые рибосомами. Рибосома присоединяется к мРНК и синтезирует белок. рРНК составляет до 80% РНК, обнаруживается в цитоплазме эукариотической клетки.
Роль РНК РНК играют важнейшую биологическую роль во всех живых организмах, участвуя в реализации генетической информации и биосинтезе белков. Макромолекулярная структура РНК представлена в основном однонитчатыми полинуклеотидными цепями, которые образуют двуспиральные участки по принципу комплементарностиоснований. Многие вирусы содержат РНК в качестве единственного нуклеинового компонента. В таких РНК-содержащих вирусах РНК могут служить матрицей для биосинтеза не только РНК, но и ДНК (обратнаятранскрипция).
22. Адениловые динулеотиды(NAD, NADP, FAD). Восстановленные формулы этих молекул.
Никотинамидадениндинуклеоти?д (НАД, NAD) — кофермент, присутствующий во всех живых клетках, входит в состав ферментов группы дегидрогеназ, катализирующих окислительно-восстановительные реакции; выполняет функцию переносчика электронов и водорода, которые принимает от окисляемых веществ. Восстановленная форма (NADH) способна переносить их на другие вещества.
Представляет собой динуклеотид, молекула которого построена из амида никотиновой кислоты и аденина, соединённых между собой цепочкой, состоящей из двух остатков D-рибозы и двух остатков фосфорной кислоты; применяется в клинической биохимии при определении активности ферментов крови.
Отличие его от другого важнейшего кофермента — никотинамидадениндинуклеотидфосфата, или NADP, в том, что последний содержит в молекуле ещё один остаток фосфорной кислоты, связанной с 21-углеродным атомом рибозы.

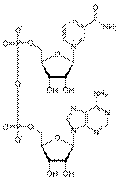 Никотинамидадениндинуклеотидфосфа?т (НАДФ, NADP) — широко распространённый в природе кофермент некоторых дегидрогеназ — ферментов, катализирующих окислительно-восстановительные реакции в живых клетках. NADP принимает на себя водород и электроны окисляемого соединения и передаёт их на другие вещества. В хлоропластах растительных клеток NADP восстанавливается при световых реакциях фотосинтеза и затем обеспечивает водородом синтез углеводов при темновых реакциях. NADP, — кофермент, отличающийся от NAD содержанием ещё одного остатка фосфорной кислоты, присоединённого к гидроксилу одного из остатков D-рибозы, обнаружен во всех типах клеток.
Никотинамидадениндинуклеотидфосфа?т (НАДФ, NADP) — широко распространённый в природе кофермент некоторых дегидрогеназ — ферментов, катализирующих окислительно-восстановительные реакции в живых клетках. NADP принимает на себя водород и электроны окисляемого соединения и передаёт их на другие вещества. В хлоропластах растительных клеток NADP восстанавливается при световых реакциях фотосинтеза и затем обеспечивает водородом синтез углеводов при темновых реакциях. NADP, — кофермент, отличающийся от NAD содержанием ещё одного остатка фосфорной кислоты, присоединённого к гидроксилу одного из остатков D-рибозы, обнаружен во всех типах клеток.
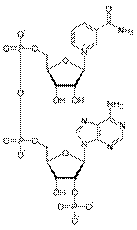 FAD — флавинадениндинуклеотид — кофермент, принимающий участие во многих окислительно-восстановительных биохимических процессах. FAD существует в двух формах — окисленной и восстановленной, его биохимическая функция, как правило, заключается в переходе между этими формами.
FAD — флавинадениндинуклеотид — кофермент, принимающий участие во многих окислительно-восстановительных биохимических процессах. FAD существует в двух формах — окисленной и восстановленной, его биохимическая функция, как правило, заключается в переходе между этими формами.
FADH2. FAD может быть восстановлен до FADH2, при этом он принимает два атома водорода.  Молекула FADH2 является переносчиком энергии и восстановленный кофермент может быть использован как субстрат в реакции окислительного фосфорилирования в митохондрии. Молекула FADH2 окисляется в FAD, при этом выделяется энергия, эквивалентная (запасаемая в форме) двум молям ATP. Основной источник восстановленного FAD у эукариот — цикл Кребса и бета-окисление липидов. В цикле Кребса FAD является простетической группой фермента сукцинатдегидрогеназы, которая окисляет сукцинат до фумарата, в бета-окислении липидов FAD является коферментом Ac-CoA дегидрогеназы. FAD образуется из рибофлавина, многие оксидоредуктазы, называемые флавопротеинами, для своей работы используют FAD как простетическую группу в реакциях переноса электронов.
Молекула FADH2 является переносчиком энергии и восстановленный кофермент может быть использован как субстрат в реакции окислительного фосфорилирования в митохондрии. Молекула FADH2 окисляется в FAD, при этом выделяется энергия, эквивалентная (запасаемая в форме) двум молям ATP. Основной источник восстановленного FAD у эукариот — цикл Кребса и бета-окисление липидов. В цикле Кребса FAD является простетической группой фермента сукцинатдегидрогеназы, которая окисляет сукцинат до фумарата, в бета-окислении липидов FAD является коферментом Ac-CoA дегидрогеназы. FAD образуется из рибофлавина, многие оксидоредуктазы, называемые флавопротеинами, для своей работы используют FAD как простетическую группу в реакциях переноса электронов.
23. Основные пищевые в-ва: жиры, белки, углеводы, суточная потребность, представление об их частичной взаимозаменяемости.
Жиры, или триглицериды — природные органические соединения, полные сложные эфиры глицерина и одноосновных жирных кислот; входят в класс липидов. В живых организмах выполняют структурную, энергетическую и др. функции.
Состав и структура: Состав жиров отвечает общей формуле: CH2-O-C(O)-R¹ | CH-О-C(O)-R² | CH2-O-C(O)-R³, где R¹, R² и R³ — радикалы (иногда различных) жирных кислот.
Природные жиры содержат в своём составе три кислотных радикала, имеющих неразветвлённую структуру и, как правило, чётное число атомов углерода (содержание «нечетных» кислотных радикалов в жирах обычно менее 0,1 %).
Жиры гидрофобны, практически нерастворимы в воде, хорошо растворимы в органических растворителях и частично растворимы в этаноле (5-10%). [1]
Природные жиры содержат следующие жирные кислоты:
Насыщенные:
стеариновая (C17H35COOH), маргариновая (C16H33COOH), пальмитиновая (C15H31COOH),
Ненасыщенные: пальмитолеиновая (C15H29COOH, 1 двойная связь), олеиновая (C17H33COOH, 1 двойная связь), линолевая (C17H31COOH, 2 двойные связи)
линоленовая (C17H29COOH, 3 двойные связи), арахидоновая (C19H31COOH, 4 двойные связи, реже встречается)
Пищевые свойства: Жиры являются одним из основных источников энергии для млекопитающих. Эмульгирование жиров в кишечнике (необходимое условие их всасывания) осуществляется при участии солей жёлчных кислот. Энергетическая ценность жиров примерно в 2 раза выше, чем углеводов, при условии их биологической доступности и здорового усвоения организмом. Жиры выполняют важные структурные функции в составе мембранных образований клетки, в субклеточных органеллах.
Благодаря крайне низкой теплопроводности жир, откладываемый в подкожной жировой клетчатке, служит термоизолятором, предохраняющим организм от потери тепла (у китов, тюленей и др.).
Суточная норма потребления жиров для взрослых составляет 70...154 граммов для мужчин, 60...102 граммов для женщин.
Белки (протеи?ны, полипепти?ды [1]) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа-аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот.
Белки — важная часть питания животных и человека (основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы), поскольку в их организмах не могут синтезироваться все необходимые аминокислоты и часть из них поступает с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются при биосинтезе белков организма или подвергаются дальнейшему распаду для получения энергии.
Функции белков в организме Так же как и другие биологические макромолекулы (полисахариды, липиды) и нуклеиновые кислоты, белки — необходимые компоненты всех живых организмов, они участвуют в большинстве жизненных процессов клетки. Белки осуществляют обмен веществ и энергетические превращения. Белки входят в состав клеточных структур — органелл, секретируются во внеклеточное пространство для обмена сигналами между клетками, гидролиза пищи и образования межклеточного вещества. Многие функции белки выполняют благодаря своей ферментативной активности. Так, ферментами являются двигательный белок миозин, регуляторные белки протеинкиназы, транспортный белок натрий-калиевая аденозинтрифосфатаза и др.
Суточная норма белка для взрослых составляет 65...117 граммов для мужчин, 58...87 граммов для женщин, при этом доля белков животного происхождения от общего количества должна составлять 50 процентов. Потребление белка ограничивают при почечной недостаточности, остром нефрите, подагре и других заболеваниях.
Углеводы (сахариды) — органические вещества, содержащие карбонильную группу и несколько гидроксильных групп.
Углеводы являются неотъемлемым компонентом клеток и тканей всех живых организмов представителей растительного и животного мира. Источником углеводов для всех живых организмов является процесс фотосинтеза, осуществляемый растениями.
По способности к гидролизу на мономеры углеводы делятся на две группы: простые (моносахариды) и сложные (дисахариды и полисахариды). Сложные углеводы, в отличие от простых, способны гидролизоваться с образованием моносахаридов, мономеров. Простые углеводы легко растворяются в воде и синтезируются в зелёных растениях. Сложные углеводы являются продуктами поликонденсации простых сахаров (моносахаридов), а в процессе гидролитического расщепления образуют сотни и тысячи молекул моносахаридов
Биологическая роль: В живых организмах углеводы выполняют следующие функции:
Структурная и опорная функции. Углеводы участвуют в построении различных опорных структур. Так целлюлоза является основным структурным компонентом клеточных стенок растений, хитин выполняет аналогичную функцию у грибов, а также обеспечивает жёсткость экзоскелета членистоногих.
Защитная роль у растений. У некоторых растений есть защитные образования (шипы, колючки и др.), состоящие из клеточных стенок мёртвых клеток.
Пластическая функция. Углеводы входят в состав сложных молекул (например, пентозы (рибоза и дезоксирибоза) участвуют в построении АТФ, ДНК и РНК) [6].
Энергетическая функция. Углеводы служат источником энергии: при окислении.
Запасающая функция. Углеводы выступают в качестве запасных питательных веществ: гликоген у животных, крахмал и инулин — у растений [1].
Осмотическая функция. Углеводы участвуют в регуляции осмотического давления в организме. Так, в крови содержится 100—110 мг/% глюкозы, от концентрации глюкозы зависит осмотическое давление крови.
Рецепторная функция. Олигосахариды входят в состав воспринимающей части многих клеточных рецепторов или молекул-лигандов.
Суточная потребность в усвояемых углеводах для взрослого человека составляет 257...586 граммов, то есть 50-60% от калорийности суточного рациона. При этом потребление добавленного сахара не должно превышать 10 процентов от суточной потребности в калориях.
взаимозаменяемость белков, жиров и углеводов, исходя из их энергетической ценности. Например, 1 г жира (9,3 ккал) можно заменить 2,3 г белка или углеводов. Однако такая замена возможна только на короткое время, так как питательные вещества выполняют не только энергетическую, но и пластическую функцию.
24. Незаменимые компоненты пищи. Пищевая ценность белков.
Белок - наиболее важный компонент пищи человека. Основные источники пищевого белка: мясо, молоко, рыба, продукты переработки зерна, хлеб, овощи.
Потребность человека в белке зависит от его возраста, пола, характера трудовой деятельности. В организме здорового взрослого человека должен быть баланс между количеством поступающих белков и выделяющимися продуктами распада. Для оценки белкового обмена введено понятие азотного баланса. В зрелом возрасте у здорового человека существует азотное равновесие, т. е. количество азота, полученного с белками пищи, равно количеству выделяемого азота. В молодом растущем организме идет накопление белковой массы, образуется ряд нужных для организма соединений, поэтому азотный баланс будет положительным - количество поступающего азота с пищей превышает количество выводимого из организма. У людей пожилого возраста, а также при некоторых заболеваниях, недостатке в рационе питания белков, незаменимых аминокислот, витаминов, минеральных веществ наблюдается отрицательный азотный баланс - количество выделенного из организма азота превышает его поступление в организм. Длительный отрицательный азотный баланс ведет к гибели организма. На белковый обмен влияют биологическая ценность и количество поступающего с пищей белка.
Биологическая ценность белков определяется сбалансированностью аминокислотного состава и атакуемостью белков ферментами пищеварительного тракта.
В организме человека белки расщепляются до аминокислот, часть из них (заменимые) являются строительным материалом для создания новых аминокислот, однако имеется 8 аминокислот (незаменимые, эссенциальные), которые не образуются в организме взрослого человека, они должны поступать с пищей. Снабжение организма человека необходимым количеством аминокислот - основная функция белка в питании. В белке пищи должен быть сбалансирован не только состав незаменимых аминокислот, но и должно быть определенное соотношение незаменимых и заменимых аминокислот, в противном случае часть незаменимых будет расходоваться не по назначению.
Биологическая ценность белка по аминокислотному составу может быть оценена при сравнении его с аминокислотным составом «идеального» белка. Для взрослого человека в качестве «идеального белка» применяют аминокислотную шкалу Комитета ФАО/ВОЗ.
Расчет аминокислотного скора, для установления биологической ценности проводят следующим образом.
Аминокислотный скор каждой незаменимой аминокислоты в идеальном белке принимают за 100 %, а в природном белке определяют процент соответствия.
Содержание аминокислоты (в мг) в 1 г испытуемого. Содержание этой же аминокислоты (в мг) в I г белка по аминокислотной шкале.
В результате определяют лимитирующую кислоту в исследуемом белке с наименьшим скором.
Например: в 1 г исследуемого белка пищевого продукта содержится (в мг): изолейцина - 45, лейцина - 75, лицина - 40, метионина и цистина (в сумме) - 25, фенилаланина и тирозина (в сумме) - 70, треонина - 38, триптофана - 11, валина - 50. При сравнении со стандартной шкалой находим, что скоры (в %) соответственно равны: 113, 107, 73, 71, 95, 113, 100. Следовательно, лимитирующими аминокислотами в белке данного продукта являются лизин (скор 73 %), сумма метионина и цистина (скор 71 %) и треонин (скор 95 %).
Наиболее близки к «незаменимому» белку животные белки. Большинство растительных белков содержат недостаточное количество незаменимых аминокислот (одной или нескольких). Так, например, белки злаковых культур, а следовательно, и полученные из них продукты неполноценны по лизину, метионину, треонину. В белке картофеля, ряда бобовых не хватает метионина и цистина (60-70 % оптимального количества).
В то же время необходимо помнить, что некоторые аминокислоты при тепловой обработке, длительном хранении продуктов могут образовать не усвояемые организмом соединения, т. е. становиться «недоступными». Это снижает ценность белка.
Биологическая ценность белков может быть увеличена добавлением лимитирующей аминокислоты или внесением компонента с ее повышенным содержанием. Так, биологическая ценность белка пшеницы может быть повышена приблизительно в два раза Добавлением 0,3-0,4 % лизина, белка кукурузы - 0,4 % лизина и 0,7 % триптофана.
Аминокислоты получают, гидролизуя белки, химическим или биологическим синтезом. Отдельные микроорганизмы при выращивании на специальных средах продуцируют в процессе своей жизнедеятельности определенные аминокислоты. Этот способ используют для промышленного получения лизина, глутаминовой кислоты и некоторых других аминокислот.
Животные и растительные белки усваиваются организмом неодинаково. Если белки молока, молочных продуктов, яиц усваиваются на 96 %, мяса и рыбы - на 93-95%, то белки хлеба - на 62-86%, овощей - на 80%, картофеля и некоторых бобовых - на 70 %. Однако смесь этих продуктов может быть биологически более полноценной.
На степень усвоения организмом белков оказывает влияние технология получения пищевых продуктов и их кулинарная обработка. Анализируя воздействие различных видов обработки пищевого сырья и продуктов (измельчение, действие температуры, брожение и т. д.) на усвояемость содержащихся в них белков, следует отметить, что в большинстве пищевых производств при соблюдении технологии не происходит деструкции аминокислот. При умеренном нагревании пищевых продуктов, особенно; растительного происхождения, усвояемость белков несколько возрастает, так как частичная денатурация белков облегчает доступ протеаз к пептидным связям. При интенсивной тепловой! обработке усвояемость снижается. Такое же влияние оказывает наличие в продуктах редуцирующих Сахаров и продуктов окисления липидов за счет их взаимодействия с белковыми компонентами пищи.
Суточная потребность взрослого человека в белке разного вида 1 -1,5 г белка на 1 кг массы тела (детей 4-1,5 г), т. е. примерно 85-100 г. Доля животных белков должна составлять приблизительно 55 % от общего его количества в рационе.
Для повышения пищевой ценности продуктов питания необходимо увеличение доли белкового компонента, сбалансированности его аминокислотного состава. Один из путей решения этой задачи - получение белковых продуктов из белоксодержащих отходов пищевых производств, например семян масличных после удаления масла (шрот), отходов мясной и молочной промышленности, и их использование для улучшения биологической ценности существующих продуктов или создание новых продуктов питания.
Создание белковых продуктов из масличных семян дает возможность не только расширить белковую сырьевую базу пищевой промышленности, но и значительно сократить потери белка, заменяя трехстадийную цепочку (растение - организм животного - организм человека) на двухстадийную (растение - организм человека).
25. Заменимые и незаменимые аминокислоты. Аминокислоты представляют собой структурные химические единицы, образующие белки, и на 16% состоят из азота. Важность аминокислот для организма определяется той огромной ролью, которую играют белки во всех процессах жизнедеятельности. Белки синтезируются в организме из аминокислот, которые образуются в результате расщепления белков, находящихся в пищевых продуктах. Именно аминокислоты являются наиболее ценными элементами питания. Аминокислоты обладают антиоксидантными свойствами, являются эндогенными сорбентами и формируют субстрат - связывающие белки, которые осуществляют непосредственный транспорт большинства активных соединений (минералов, витаминов, гормонов и т.д.)Аминокислоты условно можно разделить на три группы: незаменимые, полузаменимые, заменимые. Незаменимые аминокислоты должны поступать в организм вместе с пищей, т. к. самостоятельно человек их вырабатывать не способен.
- Валин — это один из главных составляющих роста. Также он понижает чувствительность к факторам окружающей среды, таким как холод и жара, а также улучшает мышечную координацию.
- Лейцин поддерживает нашу иммунную систему.
- Изолейцин, важнейший компонент мышечной ткани, который также выступает в организме в качестве альтернативного источника энергии.
- Фенилаланин участвует в синтезе норэпинерфина, вещества, передающего сигналы от нервных клеток к головному мозгу.
- Лизин для переработки кислорода, а также для образования каротина.
- Метионин важен для почек и печени.
- Треонин принимает участие в детоксикации печени, является одним из элементов коллагена.
- Триптофан способствует синтезу серотонина, управляет сном, аппетитом и другими потребностями.
Полузаменимые аминокислоты вырабатываются организмом только тогда, когда он получает некое количество этих аминокислот вместе с пищей. При этом все аминокислоты важны для организма, потому что каждая из них имеет особую функцию, в которой ее нельзя заменить.
- Аргинин очищает печень и способствует росту мышечных волокон. Способствует большей секреции гормона роста.
- Гистидин участвует в синтезе красных и белых кровяных телец, также важен для роста мышц.
- Тирозин может частично заменить фенилаланин для синтеза белка. Отличное противострессовое вещество.
- Цистин укрепляет соединительные ткани.
Заменимые аминокислоты. Человеческий организм способен их вырабатывать самостоятельно, без дополнительных усилий 1.Аланин участвует в регуляции сахара в крови, важен для мышечной массы. 2.Аспарагин одно из составляющих иммунной системы.3.Аспарагиновая кислота помогает выделять вредный аммиак и организма. Помогает в сопротивлении организма к усталости.4.Глютамин используется для получения энергии при длительных нагрузках. Способствует укреплению памяти.5.Глицин составление креатина, синтез красных кровяных телец. Если существует недостаток этих аминокислот, человек чувствует упадок сил.6.Пролин формирует соединительные ткани. Может использоваться как альтернативный источник энергии.7.Серин участвует в выработке клеточной энергии.8.Цитруллин создает детоксикацию аммиака, являющегося побочным продуктом метаболизма.9.Таурин необходим для адекватной работы мозга.10.Цистеин участвует в росте волос.
26. Полноценные и неполноценные белки. Значение полноценного белкового питания для человека.
Белки, поступающие в организм с пищей, разделяются на биологически полноценные и биологически неполноценные.
1. Биологически полноценными называются те белки, в которых в достаточном количестве содержатся все аминокислоты, необходимые для синтеза белка организмом. Такие белки содержатся в продуктах животного происхождения, а именно, в мясе, яйцах и молоке, наиболее полноценные (70-95 %).
2. Биологические неполноценными называются те белки, в которых отсутствуют хотя бы даже одна аминокислота, которая не может быть синтезирована организмом. Они встречаются в семечках, орехах, горохе, хлебных злаках и бобах. Однако, если их принимать с небольшим количеством белка животного происхождения, то они становятся полноценными. Смесь полноценных и неполноценных белков является более питательной, чем каждый из них в отдельности.
Значение полноценного белкового питания очень велико. Белковая недостаточность ведет к нарушению ряда функций организма, в том числе функций печени, поджелудочной железы, тонкой кишки, нервной и эндокринной систем. Кроме того, наблюдаются нарушения кроветворения, обмена жиров и витаминов, развивается атрофия мышц. В результате ослабляется работоспособность человека, снижается его сопротивляемость к инфекциям. Особенно неблагоприятно сказывается белковая недостаточность на растущем организме: замедляется его рост, нарушается образование костей, задерживается умственное развитие.
Но также вредна избыточность поступления белков. При этом страдают сердечно-сосудистая система, печень и почки, усиливаются процессы гниения в кишечнике, нарушается обмен витаминов. Взрослому человеку рекомендуется ежедневно потреблять от 50 до 60 граммов белка.
 2015-04-30
2015-04-30 22973
22973
