. Кислотно - основное равновесие – солтношение концентраций водородных и гидроксильных ионов в биологических средах.
Состоянию нормы соответствует определенный диапазон колебаний рН крови – с 7.37 до 7.44 со средней величеной 7.40. Регуляторными системами, которые обеспечивают постоянство рН крови являются буферные с-мы.
Бикарбонатная – самая управляемая с-ма клеточной жидкости и крови. Состоит из углекислоты и бикарбонатов. Механизм её действия заключается в том, что при выделении в кровь больших кол-в кислых продуктов водородные ионы соединяются с анионами бикарбоната, что приводит к образованию слабодиссациирующей угольной к-ты, избыток которой сразу разлагается на Н2О и СО2, который удаляется ч-з легкие при гипервентиляции. И так, несмотря на снижение уровня концентрации бикарбоната в крови, нормальное соотношение м-у концентрацией Н2СО3 и бикарбоната (1:20) сохраняется. рН крови остается в норме. Если в крови увеличивается кол-во основных ионов, то они соединяются со слабой угольной к-той образуя ионы бикарбоната и воду. Для сохранения нормальных соотношений основных компонентов буферной с-мы в этом случае подключаются физиологические механизмы регуляции кислотноосновного состояния: происходит задержка в плазме крови некоторого количестваСО2 в результате гиповентиляции легких, а почки начинают выделять основные соли в большем кол-ве.
Фосфатная. Буферное действие этой системы основано на возможности связывания водородных ионов ионами НРО42- с образованием Н2РО4-(Н+ + НПО42- --- Н2РО4-), а так же на взаимодействие ионов ОН- с ионами Н2РО4- (ОН- + Н2РО42- --- НРО42- + Н2О). эта система находится в тесной связи с бикарбонатной.
Белковая. При сдвиге рН в щелочную сторону диссоциация основных групп угнетается и белок ведет себя как к-та. Связывая основания эта к-та дает соль. С увеличением рН возрастает кол-во белков в ф-ме соли, а при уменьшении растет количество белков плазмы в ф-ме к-ты.
Гемоглобиновая – самая мощная с-ма крови. Участие гемоглобина в регуляции рН крови связана с его ф-ей – транспорт О2. Константа диссоциации кислотных групп гемоглобина меняется в зависимости от его насыщения О2. При насыщении он становится боле сильной к-той(ННbО2) и увеличивает отдачу в р-р ионов Н2. если гемоглобин отдает О2, он становится очень слабой органической к-той (ННb).
Нарушение кислотно - основное равновесия – ацидоз.
130.
эритроциты (в 1мл. 5*109, Эритроциты живут 100-120 дней. Ежедневно образуется 250 млрд эритроцитов.) – красные кровяные клетки лишенные ядра, ибосом, митохондрий, лизосом. Образуются в красном костном мозге. Продолжительность жизни 125 дней, разрушаются в селезенки и в печени. Почти целиком заполнены гемаглабином.
Главная функция - транспорт газов: перенос О2 и СО2. Он возможен благодаря большому содержанию гемоглобина и высокой активности фермента карбоангидразы.
Обмен эритроцитов имеет ряд особенностей:
1. В зрелых эритроцитах не идут реакции биосинтеза белков.
2. Образование энергии - только путем гликолиза, субстрат - только глюкоза.
В эритроцитах существуют механизмы предохранения гемоглобина от окисления:
1. Активно протекает ГМФ-путь распада глюкозы, дающий НАДФ.H2
2. Высока концентрация глютатиона - пептида, содержащего SH-группы
131.
Гемоглобин (Hb) имеет молекулярную массу 80000 Да. Это сложный белок с четвертичной структурой: состоит из нескольких субъединиц. У Hb 4 субъединицы. Каждая субъединица состоит из небелковой части - гема и белка глобина (всего 4 гема и 4 глобина в молекуле гемоглобина).
СИНТЕЗ ГЕМА
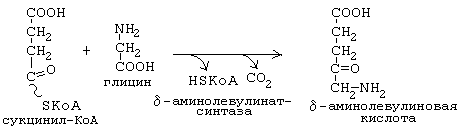
дельта-аминолевулинатсинтаза является ключевым ферментом биосинтеза гема. Коферментом дельта-аминолевулинатсинтазы является пиридоксаль-фосфат (производное витамина В6). Фермент ингибируется по принципу отрицательной обратной связи избытком гема.
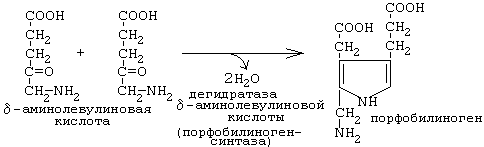
Порфобилиногенсинтаза тоже угнетается избытком гема.
Необходимо знать схему дальнейших реакций, протекающих при синтезе гема:
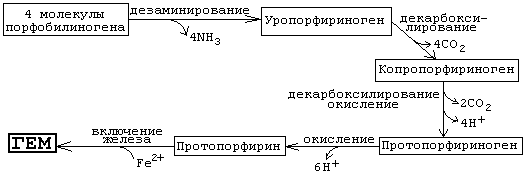
Гем имеет тетрапиррольную структуру, т.е. состоит из 4-х замещенных пиррольных колец, соединенных между собой с помощью метиновых мостиков. Эта структура называется порфирином (без железа). Протопорфирин, в который включено железо, называется ГЕМ.
Железо в Hb имеет степень окисления “+2” и координационное число 6. Двумя ковалентными связями Fe связано с азотами пиррольных колец. Две координационные связи идут на связь с остатками гистидина в молекулах глобина. Белковая часть Hb состоит из 4-х попарно одинаковых протопорфириновых циклов.
Молекула HbA (Hb взрослого человека) содержит- 2 альфа- и 2 бета-полипептидные цепи. Этот тип гемоглобина составляет приблизительно 95-97% от всего количества гемоглобина в крови.
HbA2 (2 альфа- и 2 дельта-цепи) у взрослого примерно 2%.
HbF (2 альфа и 2 гамма-цепи) - примерно 2% у взрослого. HbF - фетальный гемоглобин. В крови новорожденного такого гемоглобина содержится примерно 80%. В отличие от HbA этот тип гемоглобина имеет гораздо большее сродство к кислороду.
Сейчас установлено 5 видов HbA. Все они имеют 2 альфа- и 2 бета-цепи, но в минорных формах HbA присоединяются остатки простых сахаров (глюкозы) - гликозилированные формы гемоглобина.
У больных сахарным диабетом гликозилированных форм гемоглобина больше, чем у здоровых людей. Если снизить уровень сахара крови, то количество гликозилированнных форм снижается.
В крови человека иногда встречаются аномальные формы гемоглобина, которые отличаются от нормального Hb по аминокислотному составу полипептидных цепей. При этом изменяются изоэлектрическая точка, заряд, форма белковой молекулы. Заболевания, которые связаны с изменением структуры полипептидных цепей называются гемоглобинопатиями.
Серповидноклеточная анемия - характеризуется появлением HbS. В бета-цепи глутаминовая кислота заменена на валин вследствие мутации. Это приводит к изменению свойств Hb. Возрастает гидрофобность молекулы. Молекулы агрегируют. Эритроцит под микроскопом выглядит как серп.
В ряде случаев наблюдается одно из нарушений синтеза нормальных цепей Hb. Если нарушается синтез бета-цепей - то заболевание называется: бета-талассемия. Если нарушен синтез альфа-цепи, то альфа-талассемия.
134.
 2015-04-30
2015-04-30 1300
1300
