Молекула фермента, особенно у сложных ферментов, является очень крупной и при взаимодействии с субстратом в контакт входит лишь ее ограниченная часть – активный центр фермента. В активном центре фермента различают каталитический участок, непосредственно вступающий в химическое взаимодействие с субстратом и "контактную" (якорную) площадку, которая обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом (рис. 4.1.).
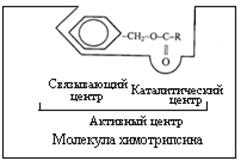
Рис.4.1. Образование фермент-субстратного комплекса.
Выявление химической природы и топографии групп активного центра является важной проблемой – необходимо определить первичную структуру и взаиморасположение аминокислот в активном центре. Для решения этого вопроса применяют различные приемы (ингибиторы, частичный гидролиз и т.д.).
Сейчас известно, что первичная структура активного центра определяется генетически, что реализуется при синтезе белка в рибосомах. Любое воздействие, связанное с денатурацией, приводит к нарушению активного центра и соответственно к потере ферментативной активности. Если удается восстановить третичную структуру фермента, то восстанавливается функция активного центра, что было доказано для рибонуклеазы поджелудочной железы.
Ферменты имеют 1,2 и более активных центра. Фермент уреаза имеет 3 активных центра, а холинэстераза – 20 активных центров. Активный центр состоит из 8-10 аминокислотных остатков, чаще всего в него входят серии, гистидин, тирозин, триптофан, глутаминовая кислота.
В молекуле фермента различают также аллостерический центр (греч. аллос – другой, стериос – пространственный). Ферменты, активность которых контролируется состоянием как активного, так и аллостерического центра, получили название аллостерических ферментов, их называют также регуляторными ферментами.
Ферменты, имеют множественные молекулярные формы, которые называют изоферменты и гетероферменты.
Изоферментами (изоэнзимами) называют белки, обладающие ферментативной активностью и катализирующие одну и ту же реакцию. Они встречаются у одного и того же вида, но отличаются между собой физико-химическими свойствами. Некоторые из них различаются между собой сродством к субстрату, коферменту и ингибитору. Например, лактатдегидрогеназа (ЛДГ) осуществляет превращение молочной и пировиноградной кислот, имеет Мм 140000 Да, ее молекула состоит из четырех субъединиц. Различают ЛДГ-1, содержащийся в мышечной ткани сердца, и ЛДГ-2 в мышечной ткани скелета; они различаются по электрофоретической подвижности.
Гетероферментами называют каталитические молекулы белков, различающиеся по размерам молекул. Ферменты, выполняющие одинаковые функции, могут встречаться в различных формах не только у различных животных, у различных органов одного и того же животного, но и в разных частях клетки.
Изоферментам принадлежит роль в регуляции отдельных звеньев обмена веществ. Например: изофермент лактатдегидрогеназы из сердечной мышцы (ЛДГ-1) резко тормозится пируватом, а скелетной мышцы – ЛДГ-2- менее чувствителен к нему.
 2015-04-30
2015-04-30 650
650







