Министерство образования Республики Беларусь
Учреждение образования
«МОГИЛЕВСКИЙ ГОСУДАРСТВЕННЫЙ
УНИВЕРСИТЕТ ПРОДОВОЛЬСТВИЯ»
Кафедра физики
АДИАБАТИЧЕСКИЕ ПРОЦЕССЫ В ГАЗОВЫХ СМЕСЯХ
к лабораторной работе № 15
для студентов 1 курса всех специальностей
Могилев 2009
УДК 53
Рассмотрены и рекомендованы к изданию научно-методическим
семинаром кафедры физики от 14.11.08 (протокол №3)
Составитель кандидат физ.-мат. наук, доцент В.Л.Малышев
Рецензент доктор физ.-мат. наук, профессор В.А.Юревич
© Могилевский государственный университет продовольствия
ПРЕДИСЛОВИЕ
Настоящие методические указания помимо подготовки к выполнению лабораторной работы могут быть использованы в качестве пособия для самостоятельного изучения или повторения некоторых тем раздела «Молекулярная физика и термодинамика»:
Степени свободы.
Уравнение Менделеева - Клапейрона.
Закон равнораспределения.
Идеальный газ.
Внутренняя энергия идеального газа.
Работа газа при изменении объема.
Виды теплоемкостей.
Теплоемкость идеального газа в изопроцессах.
Уравнение Майера.
Физический смысл универсальной газовой постоянной.
Адиабатические процессы.
Показатель адиабаты.
Уравнение адиабаты. Уравнение Пуассона.
Адиабатические процессы и их приложения.
При описании экспериментального метода, применяемого в данной работе, рассматриваются вопросы темы «Механические колебания и волны»:
Интерференция механических волн.
Стоячие волны.
Условия когерентности.
ЛАБОРАТОРНАЯ РАБОТА № 15
АДИАБАТИЧЕСКИЕ ПРОЦЕССЫ В ГАЗОВЫХ СМЕСЯХ
ЦЕЛЬ РАБОТЫ
1. Изучение адиабатических процессов путем определения показателя адиабаты как важной характеристики газов.
2. Изучение состава атмосферного воздуха.
ПРИБОРЫ И ПРИНАДЛЕЖНОСТИ: звуковой генератор, установка для изучения интерференции звуковых волн.
Степени свободы
Закон равнораспределения
Одноатомные молекулы могут двигаться только поступательно. Двух- и многоатомные молекулы кроме поступательного могут совершать также вращательное и колебательное движения. Все виды движения связаны с некоторым запасом энергии, вычислить который позволяет установленный статистической физикой закон равнораспределения энергии по степеням свободы молекул.
Числом степеней свободы механической системы называется количество независимых величин, с помощью которых может быть задано положение системы в пространстве.
Положение материальной точки определяется значениями трех ее координат. В соответствии с этим материальная точка имеет три степени свободы.
Положение системы, состоящей из двух жестко связанных материальных точек (молекула двухатомного газа), можно определить с помощью трех координат центра масс и двух углов, определяющих направление оси системы в пространстве, т.о. такая система имеет пять степеней свободы.
Система из N материальных точек, между которыми нет жестких связей, имеет (3 - N) степеней свободы. Любая жесткая связь, устанавливающая неизменное взаимное расположение двух атомов, уменьшает это число на единицу.
Абсолютно твердое тело имеет шесть степеней свободы, т.к. его положение можно определить с помощью координат (х, у, z) его центра масс и углов 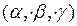 , указывающих ориентацию твердого тела в пространстве. При поступательном движении тела изменяются только координаты центра масс - соответствующие степени свободы называются поступательными. Изменения углов при неподвижном центре масс обусловливаются вращением тела - соответствующие степени свободы называются вращательными. Трехатомную молекулу и многоатомную молекулу с жесткими связями можно рассматривать как твердое тело, поэтому они имеют по 3 степени свободы поступательного и 3 - вращательного движения.
, указывающих ориентацию твердого тела в пространстве. При поступательном движении тела изменяются только координаты центра масс - соответствующие степени свободы называются поступательными. Изменения углов при неподвижном центре масс обусловливаются вращением тела - соответствующие степени свободы называются вращательными. Трехатомную молекулу и многоатомную молекулу с жесткими связями можно рассматривать как твердое тело, поэтому они имеют по 3 степени свободы поступательного и 3 - вращательного движения.
Если две материальные точки соединены упругой связью, приводящей к изменениям расстояния между атомами, то такая двухатомная молекула приобретает дополнительную колебательную степень свободы. Соответственно многоатомная молекула (трех- и более) с упругими связями имеет (3N - 6) колебательных степеней свободы.
При нормальных температурных условиях колебательные степени свободы не проявляются, поэтому в данной работе учитываются только поступательные и вращательные.
Таблица 1 - Количество степеней свободы молекул
| Вид молекулы | Вид связи | Число степеней свободы | ||
| Поступатель ные | Вращатель ные | Колебатель ные | ||
| 1-атомная 2-атомная 2-атомная 3-атомная и более (абсолютно твёрдое тело) 3-атомная и более | - жёсткая упругая жёсткая упругая | - | - - - 3N-6 |
Сколько бы степеней свободы ни имела молекула, 3 из них - поступательные. Поскольку ни одна из поступательных степеней свободы не имеет преимущества, то кинетическая энергия одноатомной молекулы (3/2) kТ равномерно распределяется на каждую из трех поступательных степеней свободы, т.е. kТ/ 2. Естественно предположить, что ни один из видов движения не имеет преимущества перед другими. Тогда на любую вращательную и колебательную степень свободы многоатомных молекул должна приходиться такая же часть энергии, а именно, kТ/ 2. Это утверждение представляет собой существо закона равномерного распределения энергии по степеням свободы молекулы (сокращенно - закон равнораспределения):
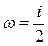 kT, (1)
kT, (1)
где 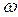 - средняя энергия молекулы;
- средняя энергия молекулы;
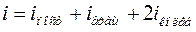
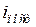 - число поступательных степеней свободы;
- число поступательных степеней свободы;
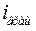 - число вращательных степеней свободы;
- число вращательных степеней свободы;
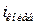 - число колебательных степеней свободы;
- число колебательных степеней свободы;
k - постоянная Больцмана (k = 1,385. 10-23 Дж/К); Т - абсолютная температура.
Число колебательных степеней свободы здесь следует удвоить, т.к. на каждую из них приходится kТ/ 2 кинетической энергии и kТ/ 2 потенциальной энергии.
Следует обратить внимание на то, что при нормальных условиях молекулы считают жесткими, поэтому они обладают только поступательными и вращательными степенями свободы. Колебательные степени свободы начинают проявляться лишь при очень высоких температурах, например, у водорода - при температурах свыше 2000 К.
 2015-05-14
2015-05-14 741
741







