В обычных условиях применения металлов и их сплавов избежать полностью коррозию невозможно, но резко уменьшить ее и свести к минимуму с помощью применения ряда методов представляется вполне осуществимым.
Изучение сущности коррозионных процессов помогает наметить основные методы предупреждения коррозии металлов.
Изоляция металла от коррозионной среды. Сообщить металлу устойчивость против коррозии можно созданием защитной плёнки на его поверхности. Эта плёнка создается различными путями. Например, покрытием корродирующего металла слоем другого металла, практически не корродирующего в тех же условиях (Сг, Ni, Zn, Sn, Со, Аg и др.). Такие покрытия называют анодными, если они изготовлены из металла с более отрицательным потенциалом, и катодными, если они состоят из металла с более положительным потенциалом.
Можно создать на поверхности металла неметаллические покрытия из неорганических веществ. Наиболее известны методы оксидирования — образования на поверхности металлов слоя оксидов, например FеО, Fе2О3, Fе3О4, А12О3 и др.; фосфатирования — отложения слоя солей Fе3(РО4)3, Мn3(РО4)2. Из органических материалов используются отверждаемые на металле плёнки полимерных веществ (каучук, пластмассы), лаки, олифа. Нередко применяются лакокраксочные композиции из полимерных и неорганических веществ. Иногда лакокрасочные покрытия наносятся на фосфатированный или оксидированный металл.
Электрохимические методы защиты (протекторная защита, электрозащита). В промышленности часто применяют так называемую протекторную защиту (рис. 12), пригодную в тех случаях, когда защищаемая конструкция (корпус судна, подземный трубопровод) находится в среде электролита (морская, почвенная вода). Для осуществления протекторной защиты используют специальный анод — протектор (например, старые железные детали, магниевые сплавы и т. д.) с более отрицательным потенциалом, чем потенциал металла защищаемой конструкции. Если соединить проводником тока В защищаемую конструкцию А и протектор Б,
последний будет разрушаться и тем самым предохранять от коррозии конструкцию А. Метод протектора применяют, используя серию анодов. Главная трудность здесь состоит в выборе способа размещения протекторов и их размеров.
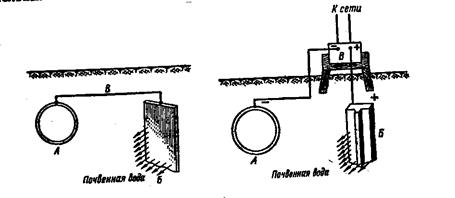
Рис. 12. Схема протекторной защиты
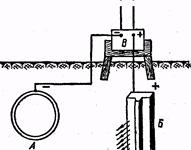
Рис. 13. Схема электрозащиты
Так называемая электрозащита (рис. 13) отличается от протекторной защиты тем, что защищаемая конструкция А, находящаяся в среде электролита (почвенная вода), присоединяется к катоду внешнего источника электричества В. В ту же среду помещают кусок старого металла (рельс, балка) Б, присоединяемый к аноду внешнего источника постоянного тока В. Поддерживая постоянное оптимальное напряжение, специально подбираемое для каждого случая, предохраняют конструкцию от коррозии.
Изменение свойств коррозионной среды. Вещества, способные при незначительных добавках их к коррозионной среде эффективно уменьшать коррозию металла или сплава, называются замедлителями (ингибиторами) коррозии. Чаще всего применяют такие замедлители коррозии, добавки которых к раствору электролита вызывают заметное изменение потенциала металла в этом растворе, приближая его к потенциалу малоактивных металлов. Анодные замедлители коррозии (карбонат натрия, фосфаты, силикаты, хроматы, нитраты и др.) способствуют уменьшению площади анодных участков на поверхности металла, уменьшая тем самым количество растворяющегося металла. Катодные замедлители коррозии (соли магния, цинка, никеля и др.) способствуют уменьшению эффективной площади катодных участков на поверхности металла, что ведет к уменьшению общей скорости коррозии за счет уменьшения количества водорода, выделяющегося на этих участках, или за счет замедления диффузии кислорода, являющегося деполяризатором. Органические вещества, являющиеся замедлителями коррозии металлов в кислых растворах, также, по-видимому, должны быть отнесены к катодным замедлителям коррозии.
Необходимая для подавления коррозии металла концентрация замедлителя определяется с учетом ряда факторов: состава и рН среды, природы металла или сплава, температуры и скорости движения среды, наличия или отсутствия в металле внешних и внутренних напряжений, а также контактов с иными металлами.
Широко распространенные в промышленности замедлители коррозии металлов в кислотах, уменьшающие скорость их растворения, но не препятствующие растворению содержащихся на их поверхностях оксидов, являются в большинстве случаев органическими веществами (тиомочевина, уротропин, производные аминов и др.). Из неорганических ингибиторов укажем только силикаты, хроматы и нитриты. Силикат и хромат натрия широко применяются в технике, например, для ослабления коррозии изготовленных из стали установок с циркулирующей по ним водой или водными растворами электролитов (охлаждающие системы).
 2015-05-20
2015-05-20 882
882








