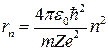 . (12)
. (12)
Подставляя найденные значения в (9) и (7), получим, что кинетическая и потенциальная энергии электрона могут принимать следующие значения:
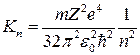 ; (13)
; (13)
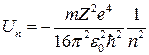 . (14)
. (14)
 Тогда полная энергия электрона
Тогда полная энергия электрона
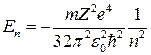 . (15)
. (15)
Здесь n, называемое главным квантовым числом, может прини-мать значения
n = 1, 2, 3,….
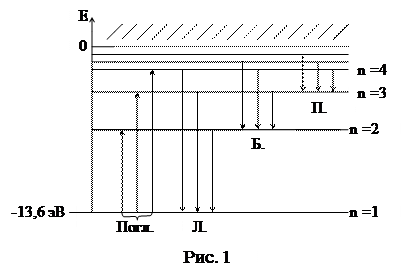
Из приведенного выражения для энергии следует, что уровни энергии электрона в атоме водорода являются неэквидистантными и их плотность возрастает с увеличением квантового числа n (см. рис. 1). Уровень, соответствующий наименьшей энергии (n = 1), принято называть основным, а состояние атома с электроном на этом уровне невозбужденным или также основным.
Для атома водорода (Z = 1) значение энергии основного состояния
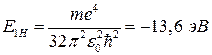 . (16)
. (16)
При значениях Е > 0 атом ионизирован. Область ионизации отмечена на диаграмме штриховкой.
Наименьшую энергию, которую необходимо передать электрону атома, находящегося в основном состоянии, для ионизации атома называют энергией ионизации атома EiH. Очевидно, для атома водорода (Z=1) эта величина равна EiH = 13,6 эВ.
Используя введенное понятие, величину En можно записать в виде
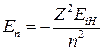 . (17)
. (17)
При поглощении фотона, если его энергии 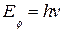 недостаточно для ионизации атома, электрон переходит с более низколежащего уровня n на более высоколежащий уровень k. При этом, согласно закону сохранения энергии
недостаточно для ионизации атома, электрон переходит с более низколежащего уровня n на более высоколежащий уровень k. При этом, согласно закону сохранения энергии
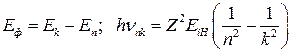 . (18)
. (18)
До температур порядка 103 К энергии теплового движения недостаточно для возбуждения атомов водорода при соударениях, поэтому возможные частоты поглощаемых фотонов описываются формулой
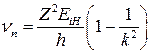 . (19)
. (19)
Соответствующие им переходы обозначаются стрелками на энергетической диаграмме.
Таким образом, спектр поглощения атомов водорода является линейчатым до предельной частоты, определяемой формулой
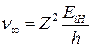 , (20)
, (20)
а затем сплошным.
Переходы атомов из состояния с более высокой энергией Ек в состояние с более низкой энергией En сопровождаются излучением фотона, частота которого определяется из закона сохранения энергии:
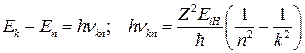 . (21)
. (21)
Возможные частоты в спектре излучения атомов водорода (Z=1) принято подразделять на серии частот, названные по именам исследовавших эти серии ученых.
Серия частот, соответствующая переходам атомов из возбужденных состояний в основное, называется серией Лаймана:
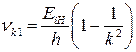 . (22)
. (22)
Эта серия лежит в ультрафиолетовом участке спектра.
Серия частот, соответствующая переходам на 2-й уровень с более высоколежащих, называется серией Бальмера:
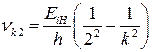 . (23)
. (23)
Частоты этой серии, соответствующие переходам с уровней k = 3, 4, 5, 6, лежат в видимом участке спектра (остальные в ультрафиолетовом), и поэтому эта серия была изучена исторически первой в 1885 г.
Следующие серии с n = 3, 4, 5 называются соответственно сериями Пашена, Брэкета, Пфундта.
Возвращаясь к серии Бальмера отметим что, так как
v = c/ 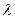 ,
, 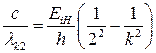 . (24)
. (24)
Измерив экспериментально длины волн, излучаемых атомами водорода, можно рассчитать энергию ионизации атома водорода:
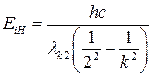 . (25)
. (25)
Экспериментальная часть
Для определения длин волн спектральных линий в данной работе используется дифракционная решетка отражательного типа с периодом d = 0,83333 мкм. Длина волны спектральной линии первого порядка для такой решетки может быть рассчитана по формуле
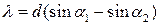 . (26)
. (26)
Для измерения углов в работе используется точный оптический прибор – гониометр, настройку и подготовку к работе которого может производить только преподаватель или лаборант. Устройство гониометра представлено на рис. 2.

Рис. 2
1. Зрительная труба.
2. Коллиматор.
3. Окуляр зрительной трубы.
4. Окуляр отсчетного микроскопа.
5. Столик.
6. Фиксатор.
7. Микрометрический винт.
8. Маховичок.
 2015-05-10
2015-05-10 397
397








