При повышении температуры цвет раствора в пробирке светлеет, а при уменьшении становиться ярко-синий (голубой) относительно контрольной пробирке.
При изменении температуры изменяется как прямая, так и обратная реакция, но в разной степени.
Для определения направления смещения равновесия необходимо определить тепловой эффект процесса.
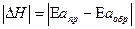
Если энергия активации прямой реакции больше энергии активации обратной, что характерна для эндотермической реакции (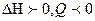 ), то с увеличением температуры скорость прямой реакции увеличивается больше чем скорость обратной (
), то с увеличением температуры скорость прямой реакции увеличивается больше чем скорость обратной (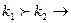 следствие из уравнение Аррениуса). Следовательно, повышение температуры увеличивает константу равновесия эндотермической реакции, т.к. увеличивается отношение
следствие из уравнение Аррениуса). Следовательно, повышение температуры увеличивает константу равновесия эндотермической реакции, т.к. увеличивается отношение 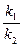 .
.
В нашем случае энергия активации прямой реакции, меньше энергии активации обратной, т.е. реакция экзотермическая (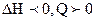 ). С увеличением температуры скорость обратной реакции увеличивается больше, чем скорость прямой (
). С увеличением температуры скорость обратной реакции увеличивается больше, чем скорость прямой (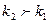 ). Следовательно повышение температуры уменьшает константу равновесия экзотермической реакции, т.к. отношение
). Следовательно повышение температуры уменьшает константу равновесия экзотермической реакции, т.к. отношение 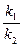 .
.
|
|
|
Вывод
При 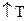 равновесие смещается в сторону эндотермической реакции(
равновесие смещается в сторону эндотермической реакции( ), а при
), а при 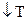 в сторону экзотермической (
в сторону экзотермической (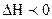
 )
)
 2015-05-10
2015-05-10 244
244







