1. Запишем химическую реакцию процесса.
4Cu+O2 = 2Cu2O находим значения ΔН и ΔS:
ΔН°= 2(ΔН°298) Cu2O
ΔS°= 2 (S°298) Cu2O – 4(S°298) Cu - (S°298) O2
Подставляя в эти уравнения значения ΔН°298 и S°298 из таблиц (Приложение 2,3):
ΔН°= 2∙(-173290)= -346580 Дж;
ΔS° = 2 ∙92,99-4∙33,2-205,2= -152,02 Дж/К.
2. Подставляем полученные значения в уравнение (4)
lg(PO2)MeO =  (4)
(4)
lg(PO2) Cu2O = 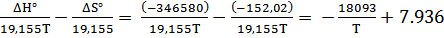
Для заданных температур получаем следующие значение упругости диссоциации:
| T, К | ||||
| lg(PO2) Cu2O | -14,68 | -12,17 | -10,16 | -8,51 |
| (PO2) Cu2O∙105 | 2,09∙10-10 | 6,80∙10-8 | 6,97∙10-6 | 3,07∙10-4 |
Из приложения 1 находим для реакции образования Cu2O:
2Cu+1/2O2 = Cu2Oт (4.1)
ΔG°= M+NT
ΔG°1 = -168519 + 71,30T
Для реакций образования Cu2O в расчете на 1 моль O2:
4Cu+O2 = 2Cu2O (4.2)
ΔG°2= ΔН°2 - Т ΔS°2
Из сопоставления реакций (4.1) и (4.2) находим: ΔG°2=2 ΔG°1
поэтому ΔН°2= 2∙(-168519) = -337038 Дж/моль;
ΔS°2 = 2∙(-71,30) = -142,06 Дж/моль∙К.
Вид температурной зависимости для (PO2) Cu2O∙105 будет следующим:
lg(PO2) Cu2O= 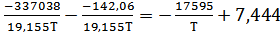
Результаты расчета по этому уравнению значений lg(PO2) Cu2O для заданных температур приведены ниже:
| T, К | ||||
| lg(PO2) Cu2O | -14,55 | -12,11 | -10,15 | -8,55 |
| (PO2) Cu2O∙105 | 2,82∙10-10 | 7,83∙10-8 | 7,06∙10-6 | 2,81∙10-4 |
III Анализ:
|
|
|
Результаты по двум расчетам мало отличаются друг от друга.
Варианты условия задачи:
| № | Оксид | № | Оксид | № | Оксид |
| Al2O3 | K2O | UO2 | |||
| B2O3 | FeO | V2O3 | |||
| BaO | Fe2O3 | UO3 | |||
| Ag2O | MnO | VO | |||
| CaO | NiO | V2O5 | |||
| Co3O4 | PbO | TiO | |||
| GeO | PdO | ZnO | |||
| GeO2 | SnO2 | TiO3 | |||
| Cr2O3 | SnO | ||||
| CuO | TiO2 |
Приложение1
Термодинамические свойства химических соединений
| Вариант | Вещество | ΔH°298 кДж/моль | S°298 Дж/(моль K) |
| Al2O3; | -1676000 | 50,95 | |
| B2O3 | -1273750 | 54,010 | |
| BaO | -553900 | 70,460 | |
| Ag2O | -31150 | 121,040 | |
| CaO | -635510 | 39,770 | |
| Co3O4 | -888000 | 103,00 | |
| GeO | -237400 | 50,200 | |
| GeO2 | -555090 | 55,310 | |
| Cr2O3 | -1141300 | 81,200 | |
| CuO | -162110 | 42,660 | |
| K2O | -363414 | 94,203 | |
| FeO | -265000 | 60,790 | |
| Fe2O3 | -822700 | 87,500 | |
| MnO | -385350 | 61,550 | |
| NiO | -239900 | 38,020 | |
| PbO | -219434 | 66,200 | |
| PdO | -115600 | 38,900 | |
| SnO2 | -581170 | 52,300 | |
| SnO | -286170 | 56,500 | |
| TiO2 | -944500 | 50,370 | |
| UO2 | -1086500 | 78,000 | |
| V2O3 | -1219870 | 98,400 | |
| UO3 | -1220240 | 98,680 | |
| VO | -432100 | 33,620 | |
| V2O5 | -1553300 | 131,000 | |
| TiO | -526300 | 34,790 | |
| ZnO | -350862 | 43,670 | |
| TiO3 | -1519000 | 77,370 |
Приложение2
Термодинамические свойства простых веществ
| Вещество | S°298 Дж/(моль K) |
| O2 | 205,17 |
| Al | 28,36 |
| B | 5,86 |
| Ba | 62,8 |
| Ag | 42,58 |
| Ca | 41,45 |
| Co | 30,06 |
| Ge | 31,15 |
| Cr | 23,66 |
| Cu | 33,17 |
| K | 64,73 |
| Fe | 27,17 |
| Mn | 32,03 |
| Ni | 29,89 |
| Pb | 64,85 |
| Pd | 35,68 |
| Sn | 51,58 |
| Ti | 30,65 |
| U | 50,33 |
| V | 28,93 |
| Zn | 41,66 |
Приложение3
Изменение энергия Гиббса для реакция образования соединений из компонентов в стандартных состояниях
| Вариант | Реакция | M Дж | N Дж/К |
| 2Al+3/2O2=Al2O3 | -1687909 | 325,150 | |
| 2B + 3/2O2 = B2O3 | -1246410 | 221,360 | |
| Ba + 1/2O2 = BaO | -557933 | 94,830 | |
| 4Ag + O2 = 2Ag2O | -30250 | -119,650 | |
| Ca + 1/2O2 = CaO | -641836 | 110,200 | |
| 3Co+2O2 = Co3O4 | -957940 | 457,240 | |
| Ge + 1/2O2= GeO | -235654 | 82,654 | |
| Ge + O2= GeO2 | -532209 | 76,356 | |
| 2Cr + 2/3O2= Cr2O3 | -1110884 | 247,480 | |
| Cu + 1/2O2= CuO | -159852 | 91,020 | |
| 2K +1/2 O2= K2O | -367224 | 157,880 | |
| Fe + 1/2O2= FeO | -262387 | 63,560 | |
| 2Fe +3/2O2= Fe2O3 | -814374 | 248,820 | |
| Mn + 1/2O2= MnO | -385186 | 73,730 | |
| Ni + 1/2O2= NiO | -234503 | 85,280 | |
| Pb + 1/2O2= PbO | -218676 | 97,800 | |
| Pd + 1/2O2= PdO | -113245 | 45,520 | |
| Sn + O2 = SnO2 | -581756 | 204,820 | |
| Sn + 1/2O2 = SnO | -284656 | 99,560 | |
| Ti + O2 =TiO2 | -939535 | 175,760 | |
| U + O2 =UO2 | -1089866 | 174,210 | |
| 2V + 2/3O2 = V2O3 | -1231129 | 239,610 | |
| U + 1/2O2 =UO3 | -1227569 | 250,710 | |
| V + 1/2O2 = VO | -415666 | 81,180 | |
| 2V + 5/2O2 =V2O5 | -1464417 | 325,310 | |
| Ti +1/2O2 = TiO | -511208 | 80,600 | |
| Zn +1/2O2 = ZnO | -493666 | 203,980 | |
| Ti +3/2O2 = TiO3 | 195,563 |
|
|
|
 2015-05-10
2015-05-10 1902
1902







