ЛАБОРАТОРНАЯ РАБОТА № 3
Тема: Кондуктометрическое титрование сильной кислоты сильным основанием
Литература: Лекция №6; [1]: С. 283-300.
Цель: приобретение навыков кондуктометрического титрования, определение концентрации раствора сильной кислоты кондуктометрическим методом.
Реактивы и оборудование:
Кондуктометр цифровой с электродом, магнитная мешалка, магнит, штатив, бюретка объемом 10 мл, воронка, стакан объемом 50 мл (под бюретку), высокий стакан объемом 150 мл для измерений электропроводности, стакан для промывания электрода, фильтровальная бумага для протирания электрода, пипетка Мора объемом 25 мл, груша резиновая, вода дистиллированная, определяемый раствор HCl≈0,1 моль/л, раствор NaOH0,5 моль/л.
Теоретические основы
Величина электропроводности раствора может служить индикаторным свойством в объемном анализе. Об эквивалентной точке судят по изменению характера зависимости электропроводности раствора от объема добавленного реагента. Обычно это является следствием появления или связывания ионов, существенно отличающихся по подвижности от исходных.
Электропроводность раствора — это сумма электропроводностей присутствующих в нем ионов. Если в процессе титрования (при добавлении титранта) изменяется состав раствора, то изменяется и его электропроводность. Рассмотрим вклад в общую электропроводность всех ионов, входящих в изучаемую систему (рис. 7):
HCl + NaOH = NaCl + H2O
в ионном виде: H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O
До начала титрования (V NaOH =0) электрическая проводимость раствора HCl обусловлена наличием в нем ионов H+ и Cl-, причем вклад H+ существенно больше (сравните значения λ∞). В процессе прибавления NaOH ионы H+ связываются ионами OH- щелочи в малодиссоциированные молекулы H2O и электропроводность, обусловленная Н+ падает. Это падение будет продолжаться до достижения V экв NaOH, пока практически все ионы Н+ не окажутся связанными в H2O и их вклад в общую электропроводность раствора будет определяться только ионным произведением воды. Концентрация ионов Cl- и обусловленная ими электрическая проводимость остается неизменной в процессе титрования.
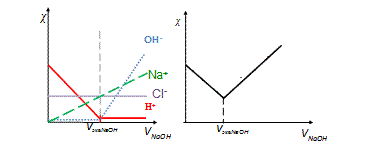
Рис. 7. Кондуктометрическое титрование сильной кислоты щелочью: (а) – вклад ионов, (б) -результирующий график
Концентрация и электрическая проводимость ионов Na+ возрастает от нуля пропорционально количеству добавленной щелочи. Электрическая проводимость, обусловленная ионами OH-, минимальна до точки эквивалентности, все добавляемые с титрующим раствором гидроксилы связываются в H2O. Однако после достижения точки эквивалентности свободных ионов H+ уже нет, и электропроводность, обусловленная добавкой OH- возрастает даже более резко, чем электропроводность за счет Na+ вследствие очень высокой подвижности ионов OH-. Общее изменение электрической проводимости раствора в процессе титрования можно получить, графически сложив рассмотренные зависимости отдельных ионов. В точке эквивалентности электрическая проводимость раствора минимальна.
 2015-05-10
2015-05-10 375
375







