“Определение отношения теплоемкости воздуха при постоянном давлении и постоянном объеме”.
Цель работы: Измерить отношение теплоемкости воздуха при постоянном давлении и теплоемкости воздуха при постоянном объеме.
Теплоемкость газа численно равна количеству теплоты, которое необходимо сообщить этому газу, чтобы увеличить его температуру на 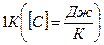 .
.
Для определения отношения теплоемкости при постоянном давлении Ср к теплоемкости при постоянном объеме Cv следует рассмотреть процесс, где это отношение играет существенную роль. Таким процессом является адиабатический процесс, описываемый уравнением Пуассона:
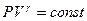 (1)
(1)
либо
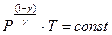 (2)
(2)
здесь Р- давление газа ([Р] = Па), V - объем газа ([v] = м3)
и 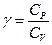 (3)
(3)
Для идеального газа
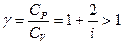 (4)
(4)
Здесь 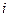 - количество степеней свободы молекулы рассматриваемого газа, т.е. число координат, достаточное для фиксации положения молекулы в пространстве между рассматриваемым газом и окружающей средой. В реальных условиях осуществить полную теплоизоляцию невозможно. Однако на практике пользуются тем фактом, что установление равновесного давления протекает очень быстро - за доли секунды, а на выравнивание температуры требуются минуты. Следовательно, осуществления процесса близкого к адиабатическому быстро изменяют давление в газе.
- количество степеней свободы молекулы рассматриваемого газа, т.е. число координат, достаточное для фиксации положения молекулы в пространстве между рассматриваемым газом и окружающей средой. В реальных условиях осуществить полную теплоизоляцию невозможно. Однако на практике пользуются тем фактом, что установление равновесного давления протекает очень быстро - за доли секунды, а на выравнивание температуры требуются минуты. Следовательно, осуществления процесса близкого к адиабатическому быстро изменяют давление в газе.
При адиабатическом процессе первое начало термодинамики (закон сохранения энергии) имеет следующий вид:
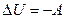 (5)
(5)
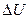 - изменение внутренней энергии газа (U –суммарная, механическая энергия всех молекул газа ([U] = Дж), А - работа при адиабатическом расширении либо сжатии ([А] = Дж).
- изменение внутренней энергии газа (U –суммарная, механическая энергия всех молекул газа ([U] = Дж), А - работа при адиабатическом расширении либо сжатии ([А] = Дж).
Если газ расширяется, то А > 0, следовательно, соглао уравнению (5) внутренняя энергия уменьшается температура газа Т понижается. При сжатии газа А - имеет место обратный эффект.
Если газ расширяется изобарически (при постоями давлении), то согласно первому началу термодинамики
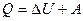 (6)
(6)
Количество теплоты Q, полученное газом, расходуется на изменение внутренней энергии и совершение работы А ([Q] = Дж).
Если же процесс изохорический (при постоянном объеме), то работа А = 0 и по первому закону гермодинамики:
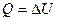 (7)
(7)
Тепло расходуется лишь на изменение внутренней энергии. Если в обоих случаях температура изменилась больше на величину совершенной работы А.
Если мы имеем один моль газа, то работа:
A=R (8)
Где R – универсальная газовая постоянная 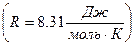 .
.
Полученный нами вывод, что Ср >Cv согласуется с соотношением (4) (9)
Так как в дальнейшем нам понадобиться уравнение изобарического и изохорического процессов, напишем уравнение Менделеева - Клапейрона – уравнение состояния идеального газа:
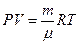 (10)
(10)
m -масса газа, 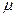 - масса моля газа.
- масса моля газа.
Ход работы:
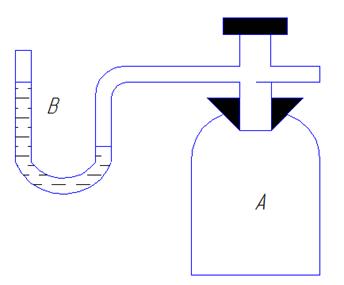
1. Накачать в сосуд воздух до тех пор, пока разность уровней жидкости в манометре не будет равна 20-25 см. Прекратив накачивание, выждать 2-3 мин, пока температура внутри сосуда не станет равной температуре окружающей среды, т.е. разность уровней в манометр стабилизируется. Записать разность (hi) в таблицу.
2. Нажать рычаг К, тем самым соединить сосуд с атмосферой. Включить секундомер. По истечении времени t, измеренному по секундомеру, ключ отпустигь. Измерения проводить несколько раз с различными промежутками времени t от 3 до 15 сек. через каждые 3 сек.
3. После закрытия ключа К выждать, пока газ нагреется до темперагуры окружающей среды, т.е. разность уровней в манометре стабилизируется, отсчитать показания манометра hi и внесите в таблицу.
4. Для каждого значения t вычислить 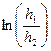 и занести полученные значения в таблицу.
и занести полученные значения в таблицу.
5. Построить график зависимости величины 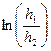 от времени по данным таблицы.
от времени по данным таблицы.
Таблица 1
| t, сек | h1, мм | h2, мм | 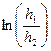 |
| 3(3,76) | 1,22 | ||
| 6(6,17) | 1,33 | ||
| 9(9,37) | 1,58 | ||
| 12(12,09) | 1,7 | ||
| 15(15,06) | 1,78 |
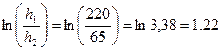
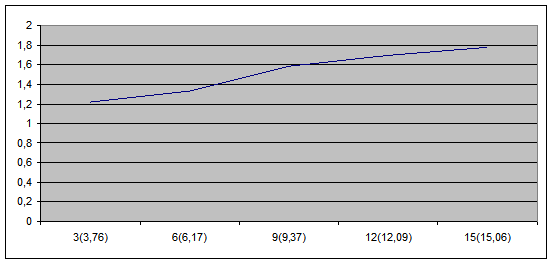
Отрезок отсекаемый экспериментальной прямой по оси ординат 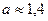
Находим 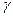 :
:
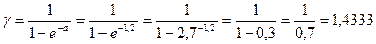
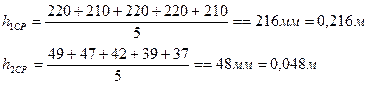
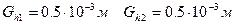
Расчетное уравнение:
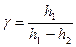
Логарифмируем уравнение:
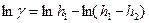
Находим частотные производные:
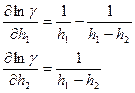
Относительная ошибка:
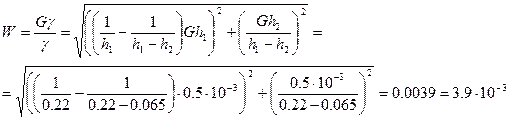
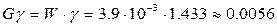
Вывод: Опытным путем определили отношение теплоемкости воздуха при постоянном давлении и постоянном объеме.
 2015-05-10
2015-05-10 9125
9125