Теплоемкостью тела Ст называют величину, равную количеству теплоты, которое нужно сообщить телу, чтобы повысить его температуру на 1 К.CT=Q/ΔT; [CT]=1Дж/К
Удельная теплоемкость вещества (с) — величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К
c=Q/mΔT; [c]=1Дж/кг*К
Теплоемкость тела связана с удельной теплоемкостью соотношением
CT=cm
Молярная теплоемкость — величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К. C=Q/υΔT
Удельная теплоемкость связана с молярной соотношением. C=cM
Удельная теплоемкость вещества не является неизменным параметром. Удельная теплоемкость может резко изменяться при переходе вещества из одного агрегатного состояния в другое. Теплоемкость зависит и от условий, при которых происходит передача теплоты телу. Например, при изотермическом расширении газа ему передается некоторое количество теплоты (Q > 0, а ΔТ = 0). Следовательно, удельная теплоемкость газа при изотермическом процессе. c=Q/mΔT→∞
При адиабатном сжатии (расширении) газ не получает теплоты и не передает ее окружающим телам (Q=0), а температура газа изменяется (ΔТ ≠ 0). Следовательно, удельная теплоёмкость газа при адиабатном процессе c=Q/mΔT
Наибольший интерес представляет теплоемкость для случаев, когда нагревание происходит при постоянном объеме или при постоянном давлении. В первом случае теплоемкость называется теплоемкостью при постоянном объеме (сV, СV), во втором — теплоемкостью при постоянном давлении (ср , Ср).
Если объем не изменяется (ΔV =0), то работа, совершенная газом, также равна нулю (А =0). Согласно первому закону термодинамики, Q = ΔU и CTV=ΔU/ΔT ΔU=CTVΔT=cVmΔT
Следовательно, теплоемкость при постоянном объеме равна изменению внутренней энергии газа при нагревании его на 1 К.
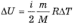 Тогда молярная теплоемкость при пост.V Сv=ΔUm/ΔT,где ΔUm=i/2*RΔT-изменение внутр.энергии 1моля газа.Из этих равенств теплоемкость газа при постоянном объеме- СV=i/2*R.Если газ нагревается при постоянном давлении,то согласно первому зак.термодинамики.Q=ΔU+A, где А=рΔV=m/M*RΔT.Тогда теплоемкость газа при постоянном давлении: CТР=Q/ΔT=ΔU/ΔT+m/M*R=i+2/2*m/M*R.Молярная теплоемкость при постоянном давлении:CP=CV+R-уравнение Маера.Отнолшение теплоемкости при постоянном давлении к теплоемкости при постоянном V: γ=CР/СV=i+2/i.
Тогда молярная теплоемкость при пост.V Сv=ΔUm/ΔT,где ΔUm=i/2*RΔT-изменение внутр.энергии 1моля газа.Из этих равенств теплоемкость газа при постоянном объеме- СV=i/2*R.Если газ нагревается при постоянном давлении,то согласно первому зак.термодинамики.Q=ΔU+A, где А=рΔV=m/M*RΔT.Тогда теплоемкость газа при постоянном давлении: CТР=Q/ΔT=ΔU/ΔT+m/M*R=i+2/2*m/M*R.Молярная теплоемкость при постоянном давлении:CP=CV+R-уравнение Маера.Отнолшение теплоемкости при постоянном давлении к теплоемкости при постоянном V: γ=CР/СV=i+2/i.
 2018-01-08
2018-01-08 1263
1263
