1) ЭДС цепи - это потенциал правого электрода относительно левого.
Zn|ZnSO4|CuSO4|Cu
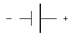
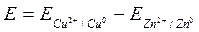
2) Предполагается, что на правом электроде происходит восстановление (присоединение электронов к участвующему в электродном процессе компоненту), а на левом - окисление. Если же в реальной системе происходят обратные процессы, то найденная величина E окажется отрицательной.
- Zn|ZnSO4|CuSO4|Cu +
Окисление восстановление
3) На границе двух растворов в цепях с переносом катионы в количестве 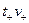 (
(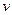 -стехиометрический коэффициент) переходят слева направо, а анионы в количестве
-стехиометрический коэффициент) переходят слева направо, а анионы в количестве 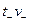 -справа налево. При противоположном направлении переноса величина E окажется отрицательной.
-справа налево. При противоположном направлении переноса величина E окажется отрицательной.
4) Сложением всех процессов с учетом условия равенства чисел электронов, возникающих на левом электроде и расходуемых на правом, получают суммарную химическую реакцию.
5) ЭДС цепи определяют по формуле 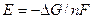 , подставляя в нее полученное выражение для
, подставляя в нее полученное выражение для 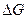 суммарной реакции в данной электрохимической цепи. При этом, если реакция идет самопроизвольно, то
суммарной реакции в данной электрохимической цепи. При этом, если реакция идет самопроизвольно, то 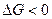 и
и 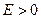
 2015-05-13
2015-05-13 453
453








