
Билет 9
1. Общая характеристика металлов главных подгрупп I – III групп (I-A – III-A
Групп) в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенности строение их атомов, металлическая химическая связь,химические свойства металлов как восстановителей.
В периодической системе элементов металлы в основном располагаются в главных
подгруппах I—Ill групп, а также в побочных подгруппах.
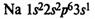
В IA группе у атомов элементов на внешнем энергетическом уровне находится 1
электрон в состоянии s1, во IIA группе у атомов на внешнем ЭУ 2
электрона в состоянии s2. Эти элементы относятся к s-элементам. В
IIIA группе у всех элементов на внешнем Энергетическом Уровне 3 электрона в состоянии s2p1. Они относятся к p-элементам.
В I A группу входят щелочные металлы Li, Na, K, Rb, Cs, Fr, активность которых при движении сверху вниз увеличивается вследствие увеличения радиуса атомов, металлические свойства возрастают также, как и у щелочеземельных металлов IIA группы Be, Mg, Ca, Sr, Ba, Ra и металлов IIIA группы Al, Ga, In, Tl.Оксиды типа R2O характерны только для Li, для всех остальных щелочных
|
|
|
металлов характерны пероксиды R2O2, которые являются сильными окислителями.
Все металлы этих групп образуют основные оксиды и гидроксиды, кроме Be и Al,
которые проявляют амфотерные свойства.
Химические свойства. Атомы металлов имеют больший радиус, чем атомы
неметаллов, поэтому легко теряют валентные электроны. Вследствие этого металлы проявляют восстановительные свойства.
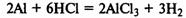
В химических реакциях металлы выступают в роли восстановителей:
1. При взаимодействии с кислородом металлы образуют оксиды, например, магний сгорает с образованием оксида магния:
2Mg + O2 = 2MgO
Наиболее активные металлы (щелочные) при горении на воздухе образуют пероксиды:
2Na + O2 = Na2O2 (пероксид натрия)
2. Активные металлы, например, натрий, реагируют с водой с образованием гидроксидов:
2Na + 2HOH = 2NaOH + H2↑
или оксидов, как магний при нагревании:
Mg + H2O = MgO + H2↑
Металлы, расположенные в электрохимическом ряду напряжений левее водорода (Н), вытесняют водород из кислот (кроме азотной). Так, цинк реагирует с соляной кислотой с образованием хлорида цинка и водорода:
Zn + 2HCl = ZnCl2 + H2↑
Металлы, в том числе правее водорода, за исключением золота и платины, реагируют с азотной кислотой, с образованием различных соединений азота:
Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2H2O + 2NO2↑
Коэффициенты в этих уравнениях легче расставить методом электронного баланса. Проставляем степени окисления:
Cu0 + 4HN+5O3 = Cu+2(NO3)2 + 2H2O + 2N+4O2↑
Записываем элементы с изменившейся степенью окисления:
| Cu0 – 2e– → Cu+2 | 2* | 1** | - восстановитель |
| N+5 + 1e– → N+4 | - окислитель |
|
|
|
 2015-05-13
2015-05-13 3048
3048








