В химическом потенциале i -го компонента (3.41') в идеальном конденсированном (твердом или жидком) растворе: 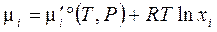 упростим обозначение
упростим обозначение 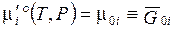 , мольной (черта сверху) энергии Гиббса чистого i -го вещества.
, мольной (черта сверху) энергии Гиббса чистого i -го вещества.
Энергия Гиббса бинарного раствора из n 1и n 2 молей веществ:
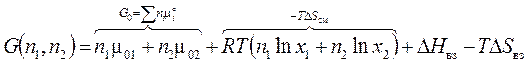 (4.1)
(4.1)
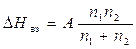 ,
, 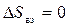 . (4.1')
. (4.1')
К идеальной её части согласно (3.40) добавлены энергетические и структурные составляющие энергии Гиббса реального раствора. При этом использовано Ван–Лааровское приближение регулярного раствора (А – параметр взаимодействия).
Химические потенциалы по определению (3.41'') соответствуют частным производным от энергии Гиббса по числу молей. Опуская технические детали дифференцирования, приведем конечный результат 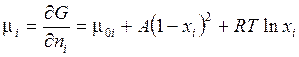 , который можно представить в виде:
, который можно представить в виде:
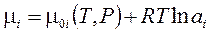 (4.2), где
(4.2), где 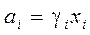 - активность, (4.2')
- активность, (4.2')
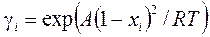 - коэффициент активности. (4.2'')
- коэффициент активности. (4.2'')
Активности растворенных веществ ввел Льюис. Это позволило в выражениях для реальных растворов сохранить форму идеальных. При этом активность компонента трактуется как исправленная концентрация.
Равновесие гетерогенной реакции испарения, исходя из условия (3.45), характеризуется равенством хим. потенциалов компонентов в жидкости (4.2) и паре (3.41) и определяет давление насыщенных паров:
|
|
|
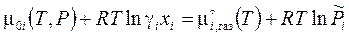 .
. 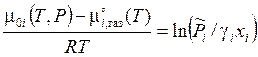 ,
,
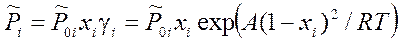 (4.3)
(4.3)
Введенное обозначение 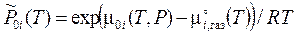 , как следует из (4.3) при xi → 1, соответствует давлению насыщенного пара чистого i -го компонента.
, как следует из (4.3) при xi → 1, соответствует давлению насыщенного пара чистого i -го компонента.
При А = 0 из (4.3) получается Pi = P 0 i xi - закон Рауля для идеального раствора.
При А > 0 энтальпия – положительна, смешение компонентов энергетически не выгодно, и растворенное вещество становится более летучим.
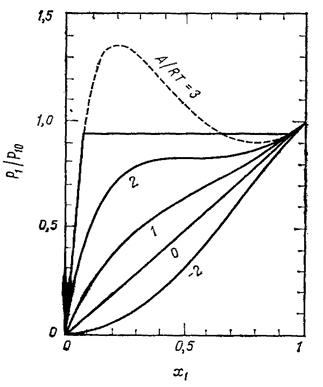 Рис. 4.1. Зависимости парциального давления пара 1-го компонента от состава бинарного раствора при различных значениях параметра А. Рис. 4.1. Зависимости парциального давления пара 1-го компонента от состава бинарного раствора при различных значениях параметра А.
| 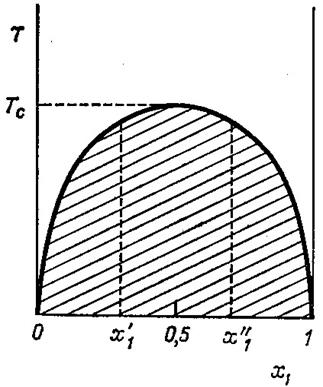 Рис. 4.2. Области существования и расслаивания (заштрихована) двухфазной системы. Тс - критическая температура. Рис. 4.2. Области существования и расслаивания (заштрихована) двухфазной системы. Тс - критическая температура.
|
При достаточно больших отношениях А/ (RT) на кривой Р 1(Т) появляется ниспадающий участок (пунктир), который соответствует термодинамически неустойчивым состояниям. Температурная зависимость максимумов х 1' и минимумов х 1'' серии таких кривых представлена на рис. 4.2. Заштрихованная часть ниже критической температуры Тс раствора соответствует области, где система расслаивается на два несмешивающихся раствора, один из которых образован преимущественно вторым компонентом (х 1'), а другой – первым (х 1'').
| Рис. 4.3. Зависимость общего давления (верхние ветви кривых) и состава пара (мольная доля у В) от состава жидкой смеси спирт (А) – этилацетат (В) при двух температурах. По оси абсцисс – мольная доля х В. |
Общее давление над раствором Р = Р 1 + Р 2 как сумма парциальных (4.3) и состав пара y 2 = P 2/ P в зависимости от состава жидкости x 2. представлены на рис. 4.3 в виде т.н. диаграммы равновесия жидкость-пар.
|
|
|
Диаграммы фазовых равновесий жидкость - пар и твердое тело – жидкость − основа обширной области прикладной химии – технологии разделения и очистки веществ.
В молекулярных растворах деление на растворитель и растворенное вещество носит условный характер и часто определяется преобладающей концентрацией одного из компонентов. Такое описание используют в нефтеперегонке, технологии высокочистых веществ, при разделении изотопов и др.
Кстати….. (история о получении изотопа чистого урана для атомной промышленности, низкотемпературная ректификация, ультрацентрифугирование, Машзавод, ОКБМ…)
 2015-05-26
2015-05-26 338
338








