По протонной теории (классификации) Бренстеда – Лаурикислота – донор протона, а основание – акцептор протона. При этом кислота, теряя протон, превращается в сопряженноеей основание. Аналогичным образом основание, присоединяя протон, становится кислотой, сопряженной основанию.
 (а)
(а)
|
(б) Основание2 + Н+ = Кислота2 пара
К-та1 + Осн-е2 =Осн-е1 + К-та2
Процесс нейтрализации – это реакция, в которой основания соревнуются за обладание протонами или реакция взаимного превращения более сильных кислот и оснований в суммарно более слабые, т.е. менее диссоциируемые соединения.
Рассмотрим количественный аспект протонной теории кислот и оснований. Напомним, что активность ai = γ i mi = fi · [ Ai ].
 (а)
(а)
|
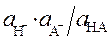
(б) (H2O + H+ = H3O+) − растворителю H2O, как слабому основанию
HA + H2O = A− + H3O+ соответствует сильная кислота H3O+.
(а) B + H+ = BH+
(б) (H2O = H+ + OH−) − вода (растворитель) играет роль слабой кислоты.
B + H2O = BH+ + OH- K b = a BH+ · a OH− / a B.
Для реакции, обратной (а) уравнение диссоциации кислоты ВН+, сопряженной основанию В имеет вид:
ВН+ = H+ + В К а = а В а Н+/ a BH+.
Произведение К b · К а = a H+ ∙ · a OH− = K W = 1,008 · 10-14 (р К W = 14,0).
| Это количественное соотношение кроме водного раствора связывает силу сопряженных кислот и оснований в любом растворителе посредством ионного произведения растворителя с константой автопротолиза К S. Таким образом, ионы растворенного вещества при участии ионов растворителя соревнуются в химических реакциях за обладание протонами в стремлении образовать энергетически более выгодные, как правило, менее диссоциированные соединения. |
|
 2015-05-26
2015-05-26 380
380








